Поликонденсация с участием дикарбоновой кислоты
Поликонденсацией терефталевой кислоты с этиленгликолем получают полиэтилентерефталат (ЛАВСАН):
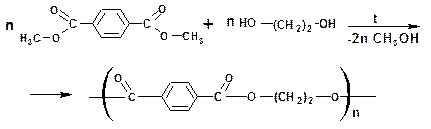
Азотсодержащие соединения
Нитросоединения
2.1.1. Классификация, номенклатура, изомерия
Определение. Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на нитрогруппу, называются нитросоединениями.
В зависимости от типа углеродного атома, с которым связана нитрогруппа, различают первичные, вторичные и третичные нитросоединения.
В зависимости от строения углеводородного радикала, с которым соединена нитрогруппа, различают нитроалканы, нитроциклоалканы и нитроарены.
Характерны два типа изомерии: положения нитрогруппы и формы, связанные со строением остального фрагмента молекулы нитросоединения.
Действуют три номенклатуры.
Тривиальные названия, например, нитрометан, нитроэтан, пикриновая кислота, нитробензол.
Название по рациональной номеклатуре может быть построено как производное нитрометана, а также от названий углеводорода с добавкой префикса нитро-. По систематической номенклатуре цифрой указывается положение нитрогруппы:
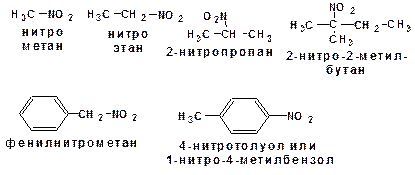
В названии нитросоединения, молекула которого включает несколько заместителей, нитрогруппа предшествует галогенам.
2.1.2. Способы получения нитросоединений
2.1.2.1. Нитрование алканов:
а) в газовой фазе (парами азотной кислоты):
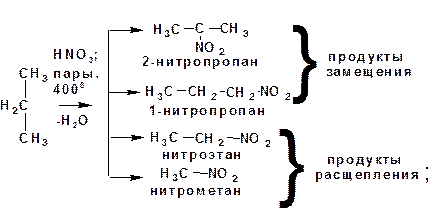
б) жидкой фазе (по Коновалову):
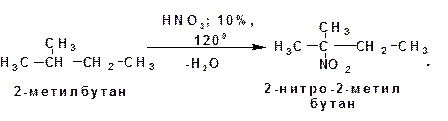
2.1.2.2. Нитрование ароматических соединений
Бензол реагирует с концентрированной азотной кислотой медленно даже при нагревании. Поэтому нитрование обычно проводят действием смеси концентрированной азотной и серной кислоты (так называемая нитрующая смесь). Нитрование аренов нитрующей смесью является основным способом получения нитросоединений ароматического ряда:
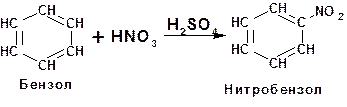
Пиридин нитруют смесью нитрата калия и серной кислоты:
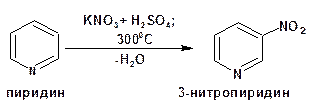
Фенол нитруют при комнатной температуре смесью азотной и уксусной кислот:
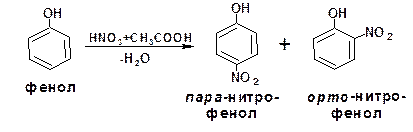
Пятичленные ароматические гетероциклы (фуран и пиррол) нитруют эфиром азотной и уксусной кислоты – ацетилнитратом:
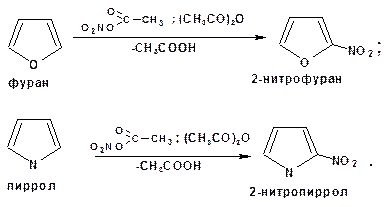
2.1.3. Химические свойства нитросоединений
2.1.3.1. Строение и свойства нитрогруппы
В нитрогруппе оба атома кислорода находятся на равном расстоянии от атома азота, а угол О-N-О равен 1200. Равноценность атомов кислорода иллюстрируют резонансные структуры:
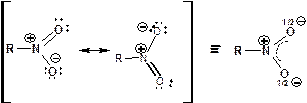
Наличие положительного заряда на атоме азота определяет высокие электроноакцепторные свойства нитрогруппы. В зависимости от радикала, соединенного с нитрогруппой, она способна проявлять отрицательные индуктивный и мезомерный эффекты, по отдельности и одновременно. Следствием данной особенности нитрогруппа в ароматических соединениях выступает в роли ориентанта II рода, способна присоединять электрон, а также обусловливает свойства С-Н кислот у алифатических нитросоединений и способствует замещению водорода у α-углеродного атома.
2.1.3.2. Реакции электрофильного замещения в ароматических нитросоединениях:
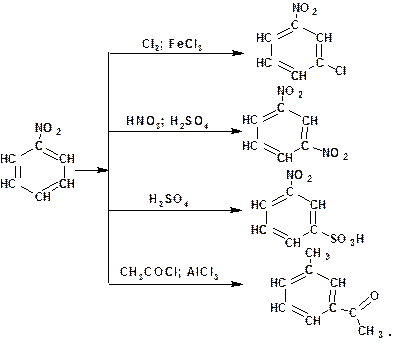
2.1.3.3. Реакции нуклеофильного замещения в ароматических нитросоединениях:
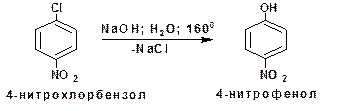
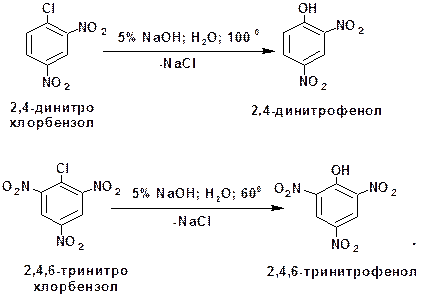
2.1.3.4. Образование солей
Первичные и вторичные нитросоединения растворимы в щелочах с образованием солей, т.е. проявляют свойства сопряженных С-Н кислот, что объясняется устойчивостью образующегося аниона:
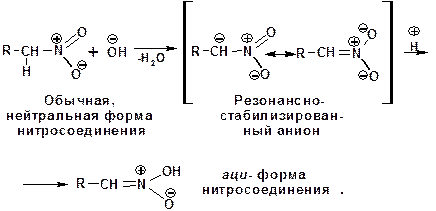
Если щелочной раствор нитросоединения обработать минеральной кислотой, то происходит образование аци-формы нитросоединения, которая изомеризуется в обычную форму. Поэтому нитросоединения относятся к псевдокислотам.
2.1.3.5. Реакция с карбонильными соединениями
Первичные и вторичные нитросоединения в присуствии щелочей нуклеофильно присоединяются по карбонильной группе альдегидов. При этом образуются нитроспирты:
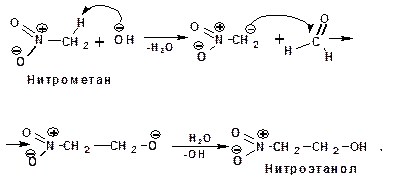
Таким образом в нитрометане можно заместить три атома водорода с образованием три-(гидроксиметил)нитрометана:
О2N-С(СН2ОН)3.
Кислотность нитросоединений очень высокая. Поэтому в случае ароматических альдегидов гидроксипроизводное соединение выделить не удается. Реакция завершается на стадии ненасыщенного нитросоединения:
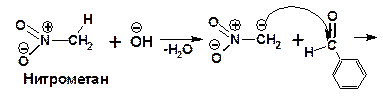
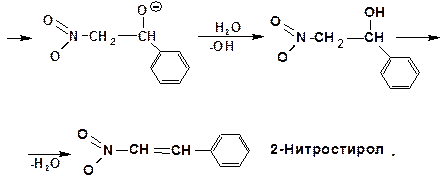
2.1.3.6. Реакция с азотистой кислотой
Первичные и вторичные нитросоединения реагируют с азотистой кислотой НNO2. В водном растворе азотистая кислота может распадаться следующим образом:
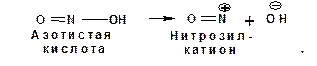
Образующийся ион гидроксила отщепляет протон от α-углеродного атома и образующийся анион присоединяется к атому азота нитрозил-катиона:
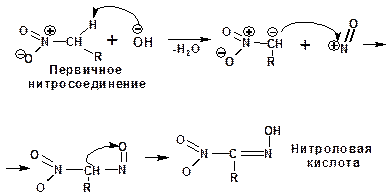

Из первичных нитросоединений образуются нитроловые кислоты.
Вторичные нитросоединения образуют псевдонитролы, обладающие ярко-синей окраской.
Третичные нитросоединения не имеют атома водорода у α-углеродного атома, поэтому не способны вступать реакции по типу альдольно-кротоновой конденсации.
2.1.3.7. Восстановление нитросоединений
Основной реакцией, характеризующей свойства нитросоединений, является реакция восстановления нитрогруппы до аминогруппы. Реакция может протекать в кислой и щелочной средах. В качестве восстановителей могут быть использованы: железо или цинк в соляной кислоте, двухлористое олово в соляной кислоте, водород на катализаторах гидрирования, электрохимическое восстановление, восстановление сульфидом аммония:
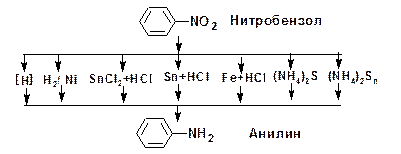
Классическая реакция восстановления нитробензола осуществлена Н.Н. Зининым с использованием полисульфида аммония (NH4)2Sn.
Механизм реакции восстановления нитробензола в кислой и нейтральной среде:
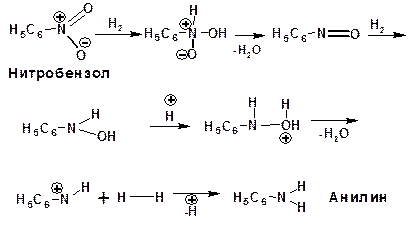
Амины
Дата добавления: 2018-09-24; просмотров: 1127;
