Химические свойства аминов
2.2.3.1. Кислотно-основные свойства
Первичные и вторичные амины являются слабыми N-H–кислотами. Они слабее спиртов (рК = 16-17). Однако под действием очень сильных оснований, например, металлоорганические соединения, амины образуют соли, причем анионы в этих солях также являются сильными основаниями (амид натрия NaNH2):
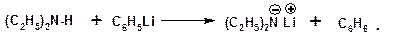
Водные растворы аминов имеют основный характер, что обусловлено образованием полностью ионизированных алкилзамещенных гидроксида аммония:
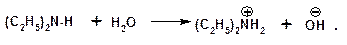
С минеральными кислотами амины образуют соли:
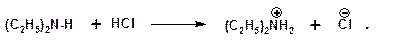
Ароматические амины более слабые основания. Дифениламин значительно слабее анилина. Трифениламин практически не обладает основными свойствами.
2.2.3.2. N-алкилирование аминов: см. пп. 2.2.2.1 и 2.2.2.2.
2.2.3.3. N-ацилирование аминов:
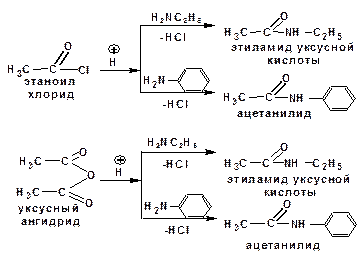
2.2.3.4. Образованием иминов
Первичные ароматические амины взаимодействуют с альдегидами и кетонами с образованием иминов или Шиффовых оснований:
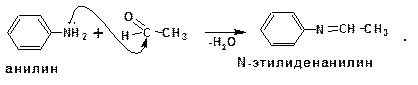
2.2.3.5. Электрофильное бромирование ароматических аминов
Бромирование анилина протекает в воде в отсутствие катализатора. В ходе реакции бром количественно присоединяется в три положения:
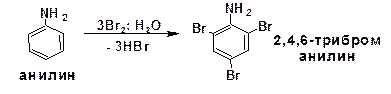
Чтобы задержать реакцию на стадии монозамещения, приходится снижать активирующее действие аминогруппы, что достигается ацилированием. Ациламиногруппа сохраняет свойства ориентанта первого рода. Бромирование в среде уксусной кислоты в этом случае приводит к образованию продуктов монозамещения:
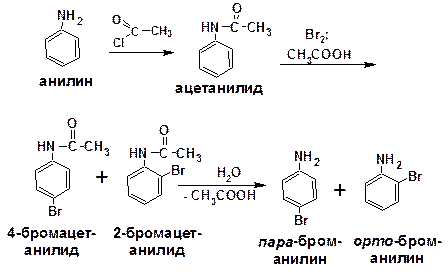
2.2.3.6. Электрофильное нитрование ароматических аминов
При электрофильном нитровании ароматических соединений, имеющих в качестве заместителей ориентанты I-го рода, образуются продукты, у которых второй заместитель занимает орто- и пара-положения. Однако амины, будучи основаниями, в первую очередь взаимодействуют с кислотами с образованием аммонийных солей. Аммонийная группа является мета-ориентантом, дезактивирующим электрофильную атаку. Поэтому при воздействии на анилин нитрующей смеси образуется смесь орто-, пара- и мета-нитроанилинов:
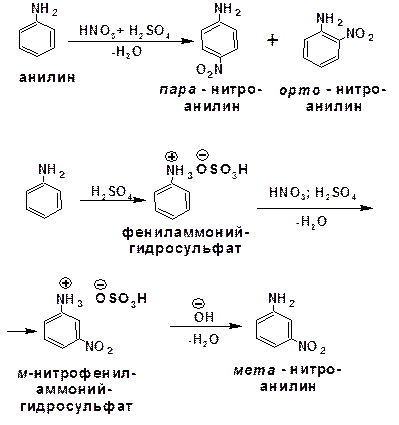
Для снижения активности анилина и предотвращения окислительных процессов проводят предварительное ацилирование аминогруппы:
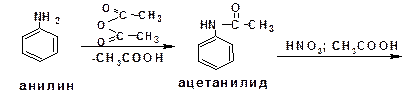
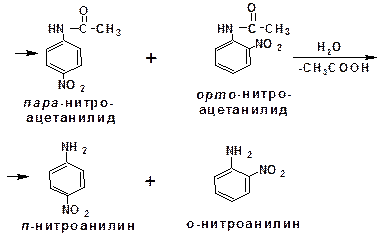
2.2.3.7. Электрофильное сульфирование ароматических аминов
Сульфирование анилина проводят концентрированной серной кислотой при 180-2000С. Продуктом реакции является анилин-4-сульфокислота, или сульфаниловая кислота:
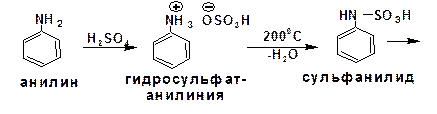
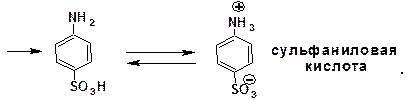
Сульфаниловая кислота имеет строение внутренней соли. Она нерастворима в кислотах, плохо растворима в холодной воде, хорошо растворима в горячей воде, а также – в щелочах.
2.2.3.8. Реакции первичных алифатических аминов с азотистой кислотой
Реакции первичных алифитических аминов протекают в соответствии со следующим механизмом:
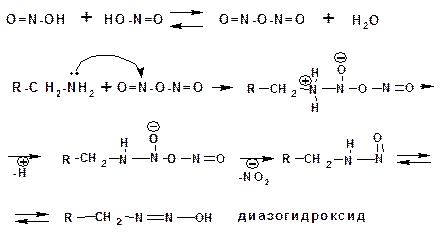
В кислой среде диазогидроксид подвергается дальнейшему превращению:
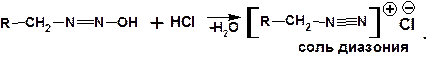
Образующийся из диазогидроксида диазокатион для алифатических аминов является нестойким. Он легко отщепляет молекулу азота с образованием обычного карбкатиона:
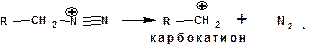
Карбкатион может быть стабилизирован либо присоединением нуклеофильной частицы, в частности, гидроксила, либо отщеплением протона:
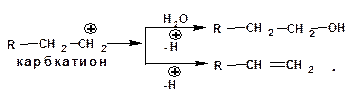
2.2.3.9. Реакции вторичных и третичных алифатических аминов с азотистой кислотой
В ходе взаимодействия вторичных аминов с азотистой кислотой реакция останавливается на стадии отщепления нитрит-аниона. При этом образуется нитрозоамин:
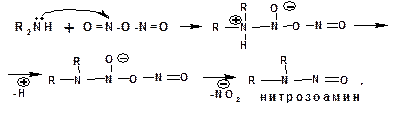
Третичные амины в слабокислой среде расщепляются с образованием карбонильного соединения и нитрозоамина:
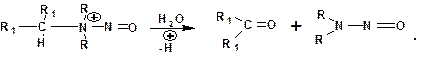
Дата добавления: 2018-09-24; просмотров: 1518;
