При построении уравнения поступают следующим образом: горючее вещество и участвующий в горении воздух помещают в левой части уравнения, в правой – образующиеся продукты горения.
Целый ряд горючих веществ и материалов может быть определён формулой 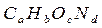 , где индексы a, b, c, d отвечают количеству атомов углерода, водорода, кислорода, азота в молекуле горючего вещества. Известно, что воздух представляет собой смесь газов, основными компонентами которой являются азот (78%), кислород (21%), аргон (0,9%). Процентное содержание газов приведено по объёму. Аргон, как инертный газ, в процессе горения не участвует. Для простоты расчётов принимают, что воздух состоит из 21% кислорода и 79% азота, то есть на один объём кислорода в воздухе приходится 79/21=3,76 объёма азота, или на каждую молекулу кислорода приходится 3,76 молекул азота. Тогда левая часть уравнения (без учёта согласующих коэффициентов) может быть представлена в виде
, где индексы a, b, c, d отвечают количеству атомов углерода, водорода, кислорода, азота в молекуле горючего вещества. Известно, что воздух представляет собой смесь газов, основными компонентами которой являются азот (78%), кислород (21%), аргон (0,9%). Процентное содержание газов приведено по объёму. Аргон, как инертный газ, в процессе горения не участвует. Для простоты расчётов принимают, что воздух состоит из 21% кислорода и 79% азота, то есть на один объём кислорода в воздухе приходится 79/21=3,76 объёма азота, или на каждую молекулу кислорода приходится 3,76 молекул азота. Тогда левая часть уравнения (без учёта согласующих коэффициентов) может быть представлена в виде 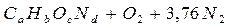 .
.
При определении продуктов сгорания нужно ориентироваться на состав горючего вещества. Углерод горючего при полном сгорании превращается в углекислый газ 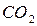 , водород - в воду
, водород - в воду 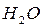 (пары воды). Азот воздуха в процессе горения участия не принимает, он целиком переходит в продукты сгорания. Содержащийся в горючем веществе кислород выделяется в виде соединений с другими элементами горючего, в рассматриваемом случае в виде, например,
(пары воды). Азот воздуха в процессе горения участия не принимает, он целиком переходит в продукты сгорания. Содержащийся в горючем веществе кислород выделяется в виде соединений с другими элементами горючего, в рассматриваемом случае в виде, например, 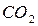 или
или 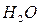 (поэтому при горении веществ, богатых кислородом, как правило, требуется меньше воздуха). Таким образом, правую часть уравнения (без учёта согласующихся коэффициентов) можно представить в виде
(поэтому при горении веществ, богатых кислородом, как правило, требуется меньше воздуха). Таким образом, правую часть уравнения (без учёта согласующихся коэффициентов) можно представить в виде 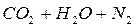 .
.
В дальнейшем необходимо найти согласующие коэффициенты. Согласно закону сохранения масс, масса веществ, вступивших в реакцию, должна быть равна массе веществ, полученных в результате реакции. Следовательно, число атомов одного и того же элемента в правой и левой частях уравнения должно быть одинаковым, независимо от того, в состав какого вещества этот элемент входит. Сначала уравнивают число атомов углерода, затем водорода, кислорода, азота. Окончательно рассматриваемое уравнение реакции горения будет иметь вид:
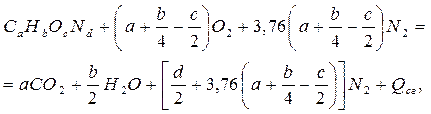 (1.33)
(1.33)
где 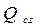 - тепловая энергия, выделяющаяся в процессе рассматриваемой реакции.
- тепловая энергия, выделяющаяся в процессе рассматриваемой реакции.
Следует отметить, что по уравнению (1.33) расчёт ведётся на один моль горючего вещества, поэтому в левой и правой частях уравнения перед 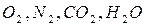 могут появиться дробные коэффициенты.
могут появиться дробные коэффициенты.
Если в состав горючего вещества, кроме углерода и водорода, входят хлор или сера, то при горении они выделяются в виде 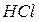 и
и 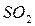 соответственно.
соответственно.
Сгорание веществ может происходить также за счёт кислорода, находящегося в составе других веществ, способных его отдавать. Такими веществами являются азотная кислота 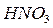 , бертолетова соль
, бертолетова соль 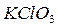 , селитры
, селитры 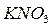 ,
, 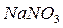 ,
, 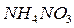 , и др. Смеси этих окислителей с горючим веществом взаимодействуют с большой скоростью, часто со взрывом [6].
, и др. Смеси этих окислителей с горючим веществом взаимодействуют с большой скоростью, часто со взрывом [6].
Количество тепла 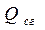 , выделяемое при полном сгорании вещества и отнесённое к единице массы (или одному молю), называется теплотой сгорания. Теплоту сгорания можно вычислить, пользуясь законом Гесса Г.Г., который является частным случаем закона сохранения энергии. Существо закона состоит в следующем: тепловой эффект химического превращения не зависит от пути, по которому протекает реакция, а зависит лишь от начального и конечного состояния системы при условии, что температура и давление (или объём) в начале и конце реакции одинаковы.
, выделяемое при полном сгорании вещества и отнесённое к единице массы (или одному молю), называется теплотой сгорания. Теплоту сгорания можно вычислить, пользуясь законом Гесса Г.Г., который является частным случаем закона сохранения энергии. Существо закона состоит в следующем: тепловой эффект химического превращения не зависит от пути, по которому протекает реакция, а зависит лишь от начального и конечного состояния системы при условии, что температура и давление (или объём) в начале и конце реакции одинаковы.
С целью пояснения рассмотрим пример вычисления теплоты сгорания метана. Реакции получения и сгорания метана можно записать в виде [6]:
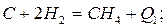 Q1=74,8 кДж
Q1=74,8 кДж
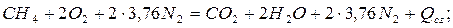
Дата добавления: 2018-03-01; просмотров: 561;
