Теория цепных реакций горения
Цепными называются реакции, идущие через ряд стадий ( через ряд промежуточных реакций), в которых образуются промежуточные соединения со свободными валентностями и, так называемые, активные центры, являющиеся зародышами последующих быстропротекающих процессов.
Известно, что при освещении смеси водорода с хлором молекула хлора, поглощая квант световой энергии hv, распадается на атомы. Атомы хлора практически мгновенно вступают в реакцию с водородом, в результате происходит взрыв смеси. Активизация одной молекулы хлора должна была вызвать образование двух молекул HC1
. .
C12 + hυ = C1 + C1
. .
C1 + C1 + H2 = 2HC1
Однако в действительности образуется ~ 105 молекул HC1.Такое явление можно объяснить, если предположить, что при взаимодействии атома хлора с водородом образуется активный продукт, который вступая во вторичные реакции, возрождается и может продолжить реакцию. Данному предположению соответствует следующая схема реакции:
. .
I. C12 + hυ = C1 + C1 первичная реакция
. .
II. C1 + H2 = HC1 + H
. .
III. H + C12 = HC1 + C1
. .
C1 + H2 = HC1 + H развитие цепи
. .
H + C12 = HC1 + C1 и т.д.
. .
IV. C1 + C1 = C12 обрыв цепи
Горение газов. 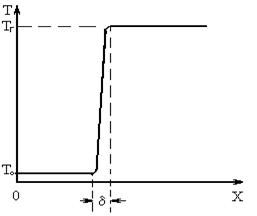
Процесс горения начинается в результате воспламенения (либо самовоспламенения) горючего вещества. Инициирование горения газовой смеси в одной точке приводит к нагреву близлежащих слоев, в них также начинается химическое превращение. Сгорание этих слоев влечет за собой инициирование горения следующих слоев и так до полного выгорания горючей смеси. Таким образом, при зажигании горючая смесь сгорает послойно.
Зона, в которой происходит химическое превращение и интенсивный разогрев сгорающего газа, перемещается по смеси, обеспечивая распространение пламени. Ширина (толщина) фронта пламени газовых смесей при атмосферном давлении составляет несколько десятых долей миллиметра, рис. 3. Аналогично горят парообразные горючие смеси.
Рис.3. Распределение температуры в газовой смеси, по которой распространяется пламя
Следует отметить, что при перемещении фронта пламени температура несгоревшей части горючей смеси возрастает, так как происходит передача тепла теплопроводностью, диффузией нагретых молекул и излучением, а также вследствие повышения давления смеси. При этом происходит увеличение скорости движения пламени. Так как скорость химической реакции при высокой температуре велика, горение такой смеси происходит чрезвычайно быстро и может носить характер взрыва.
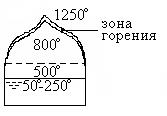 Горение горючих жидкостей происходит в газовой фазе. В результате испарения над поверхностью жидкости образуется паровая подушка, взаимодействие которой с кислородом воздуха обеспечивает формирование зоны горения. Упрощенная схема горения показана на рис. 4.
Горение горючих жидкостей происходит в газовой фазе. В результате испарения над поверхностью жидкости образуется паровая подушка, взаимодействие которой с кислородом воздуха обеспечивает формирование зоны горения. Упрощенная схема горения показана на рис. 4.
Зоной горения является тонкий светящийся слой газов, в который с поверхности жидкости поступают горючие пары, а из воздуха диффундирует кислород. В результате горения происходит выгорание жидкости.
Рис. 4. Схема горения жидкости
Горение твердых веществ отличается наличием стадии разложения и газификации. Под воздействием тепла происходит нагрев твердой фазы, сопровождающийся разложением и выделением газообразных продуктов. Затем эти продукты воспламеняются и сгорают. Тепло от образовавшегося пламени воздействует на поверхность твердого вещества, вызывая поступление в зону горения новых порций горючих газов. При горении обычно наблюдаются следующие зоны:
- прогрева конденсированной фазы;
- пиролиза, или реакционной зоны в конденсированной фазе, в которой образуются газообразные летучие вещества;
- предпламенной в газовой фазе, в которой происходит образование горючей смеси;
- пламени, или реакционной зоны в газовой фазе, в которой происходит превращение продуктов пиролиза в газообразные продукты горения.
В качестве примера на рис.5 представлена схема процесса горения древесины от подогрева до угольной фазы. Основу древесины составляет клетчатка(C6H10O5), которая содержит значительное количество собственного кислорода. При подогреве молекула клетчатки становиться непрочной и с дальнейшим повышением температуры может распасться.
Установлено, что при температуре от 0º < t < 100º нагрев древесины происходит без видимых изменений, при 100º < t < 150º происходит испарение влаги, при 150º < t < 300º имеет место нарастающий процесс разложения древесины с выделением горючих газов, при 300º < t < 500º происходит постепенное замедление процесса разложения внутри обугленной частицы, при 500º < t < 800º - горение углей с выделением CO и CO2.
По мере удаления из частиц летучих веществ, светящееся пламя начинает спадать и, наконец, исчезает совсем. Таким образом древесина не горит с поверхности, а разлагается с нее. Горит топливный газ. В конце процесса горения остаются углеродные частицы, окруженные полупрозрачным синеватым пламенем окиси углерода воздуха. В результате интенсивного окисления кислородом воздуха углеродные частицы быстро сгорают и превращаются в золу.
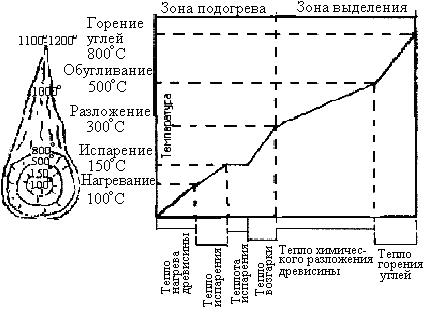
Рис. 5. Схема горения древестны
Горение пылей. Пыль – это дисперсная система, состоящая из газообразной дисперсионной среды и твердой дисперсной фазы. Обычно дисперсионной средой является воздух, а дисперсной фазой – твердое вещество в раздробленном состоянии с частицами менее 750 мкм (Гост 12.1.043- )
Пыль может находиться в осевшем и взвешенном состоянии. Осевшая пыль называется аэрогелем ; находящаяся во взвешенном состоянии – аэрозолем . Аэрогели и аэровзвеси являются гетерогенными системами. Аэровзвеси по своим свойствам занимают промежуточное положение между аэрогелями и гомогенными газовоздушными смесями. Аэровзвеси сходны с аэрогелями тем, что обе системы являются гетерогенными дисперсными системами с одинаковой твердой фазой; с газовоздушными смесями – тем, что горение большинства из них происходит с большой скоростью (в форме взрывного горения).
Склонность аэровзвесей к слипанию частиц и их осаждению обуславливает меньшую вероятность взрыва по сравнению с газовоздушными смесями; кроме того, для воспламенения аэровзвеси требуется более высокая энергия зажигания (примерно на два порядка выше, чем для газовоздушной смеси).
Дата добавления: 2018-03-01; просмотров: 2474;
