Диффузионное и кинетическое горение.
В процессе горения наблюдаются две стадии: создание молекулярного контакта между горючим и окислителем (физическая) и взаимодействие молекул с образованием продуктов реакции (химическая). Вторая стадия наступает только при условии достижения молекулами энергетически или химически возбужденного (активного) состояния. Возбуждение, или активизация молекул при горении происходит за счет их нагревания.
Время полного сгорания единицы массы любого вещества tг складывается из времени, необходимого для возникновения физического контакта между горючим веществом и кислородом воздуха tф ( в случае гомогенного горения величина tф называется временем смесеобразования, а в случае гетерогенного – временем диффузии кислорода из воздуха к твердой поверхности горения) и времени протекания самой химической реакции горения tх, то есть tг=tф+tх. В зависимости от соотношения tф и tх различают диффузионное и кинетическое горение.
При горении химически неоднородных горючих систем кислород воздуха диффундирует сквозь продукты сгорания к горючему веществу и затем вступает с ним в химическую реакцию. Время tф значительно больше tх и практически tг @ tф. Такое горение называется диффузионным.
Если время tф<<tх, то можно принять tг @ tх. Такое горение называется кинетическим.Так горят химически однородные горючие системы, в которых молекулы кислорода равномерно перемешаны с молекулами горючего вещества, и не затрачивается время на смесеобразование.
Если продолжительность химической реакции и физическая стадия процесса горения соизмеримы, то горение протекает в так называемой промежуточной области, в которой на скорость горения влияют как химические, так и физические факторы.
Горение любого материала происходит в газовой или паровой фазе. Жидкие и твердые горючие материалы при нагревании переходят в другое состояние – газ или пар, после чего воспламеняются. При установившемся горении зона реакции выполняет роль источника воспламенения для остального горючего материала.
Область газообразной среды, в которой интенсивная химическая реакция вызывает свечение и тепловыделение, называется пламенем. Пламя является внешним проявлением интенсивных реакций окисления вещества. При горении твердых веществ наличие пламени не обязательно. Один из видов горения твердых веществ – тление (беспламенное горение), при котором химические реакции идут с небольшой скоростью, преобладает свечение красного цвета и слабое тепловыделение. Пламенное горение всех видов горючих материалов и веществ в воздушной среде возможно при содержании кислорода в зоне пожара не менее 14% по объему, а тление горючих твердых материалов продолжается до содержания кислорода ~ 6%.
Таким образом, горение – это сложный физико-химический процесс.
Современная теория горения основана на следующих положениях. Сущность горения состоит в отдаче окисляющимся веществам валентных электронов окислителю. В результате передачи электронов изменяется структура внешнего (валентного) электронного уровня атома. Каждый атом при этом переходит в наиболее устойчивое в данных условиях состояние. В химических процессах электроны могут полностью переходить из электронной оболочки атомов одного вида в оболочку атомов другого вида. Для получения представления о данном процессе рассмотрим несколько примеров.
Так, при горении натрия в хлоре атомы натрия отдают по одному электрону атомам хлора. При этом на внешнем электронном уровне атома натрия оказывается восемь электронов (устойчивая структура), а атом, лишившийся одного электрона, превращается в положительный ион. У атома хлора, получившего один электрон, внешний уровень заполняется восьмью электронами, и атом превращается в отрицательный ион. В результате действия электростатических сил происходит сближение разноименно заряженных ионов и образуется молекула хлорида натрия (ионная связь)
Na + + C1 - → Na + C1-
В других процессах электроны внешних оболочек двух различных атомов как бы поступают в «общее пользование », стягивая тем самым атомы в молекулы (ковалентная связь)
.. ..
H ∙ + · C1 : → H : C1 :
˙˙ ˙˙
Атомы могут отдавать в «общее пользование» один и более электронов.
В качестве примера на рис.2 приведена схема образования молекулы метана из одного атома углерода и четырех атомов водорода. Четыре электрона атомов водорода и четыре электрона внешнего электронного уровня атома углерода поступают в общее пользование, атомы «стягиваются» в молекулу.
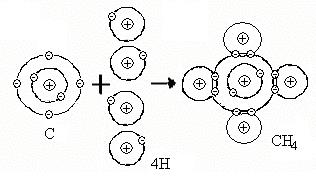
Рис.2. Схема образования молекулы метана
Учение о горении имеет свою историю. Среди ученых, исследовавших процессы горения, необходимо отметить А.Н. Баха и К.О. Энглера, разработавших перекисную теорию окисления, согласно которой при нагревании горючей системы происходит активация молекулы кислорода путем разрыва одной связи между атомами.
O2 → -O-O-
молекула активная молекула
 Активная молекула кислорода легко вступает в соединение с горючим веществом и образует соединение типа R-O-O-R (перекиси) и R-O-O-H (гидроперекиси); здесь R-символ радикала. Радикалы- частицы (атомы или атомные группы), обладающие неспаренными электронами, например,
Активная молекула кислорода легко вступает в соединение с горючим веществом и образует соединение типа R-O-O-R (перекиси) и R-O-O-H (гидроперекиси); здесь R-символ радикала. Радикалы- частицы (атомы или атомные группы), обладающие неспаренными электронами, например,  ,
,  , и др. Пример такой реакции:
, и др. Пример такой реакции:
CH4 + -O-O- → 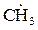 -O-O-
-O-O- 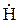
гидропероксид метила
Энергия разрыва связи -О-О- в перекисях и гидроперекисях значительно ниже ,чем в молекуле кислорода О2, поэтому они очень реакционны. При нагревании они легко распадаются с образованием новых веществ или радикалов. При этом выделяется тепло.
Дальнейшее развитие учения о горении связано с трудами Н.Н. Семенова, создавшего теорию цепных реакций горения, позволившую глубже проникнуть в физику явления и объяснить различные режимы горения, в том числе самовоспламенение, дефлаграционное горение и горение, приводящее к взрыву. Кроме того, отличие современного представления о механизме горения от перекисной теории состоит в том, что начальной фазой процесса является не активация молекул кислорода, а активация молекул окисляющегося вещества [1,6].
Дата добавления: 2018-03-01; просмотров: 2743;
