Растворение железа в щелочных растворах (Б.Н.Кабанов, Д.И.Лейкис, Р.Х. Бурштэйн, А.М.Фрумкин).
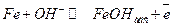 (14.к)
(14.к)
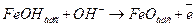 (14.л)
(14.л)
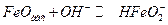 (14.м)
(14.м)
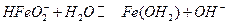 (14.н)
(14.н)
Очевидно, что в рассмотренной последовательности реакций замедленной является стадия переноса второго электрона с образованием адсорбционного оксида железа (14.л). А стадия последней химической реакции является быстрой.
Лекция 15 Анодное растворение и электрохимическая коррозия металлов.
Основные положения кинетической теории коррозии. Коррозия технических металлов и методы защиты от коррозии. Пассивность металлов. Основы электрохимической размерной обработки металлов.
В тех случаях, когда металл является анодом, возможно протекание нескольких типов реакций:
1. анодное растворение металла:
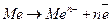 ; (15.а)
; (15.а)
2. окисление компонентов воды (растворителя) с выделением кислорода; при этом металл не растворяется, например:
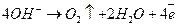 ; (15.б)
; (15.б)
- окисление компонентов раствора, например хлорид-иона:
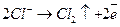 . (15.в)
. (15.в)
Во всех трёх случаях на аноде происходит окисление, но в случае 1 (15.а) компоненты металла переходят в раствор, то есть осуществляется анодное растворение, а в случае 2 и 3 имеет место окисление компонентов раствора без изменения состояния твёрдой фазы. Реакция (15.а) может протекать с участием воды с образованием оксида:
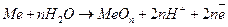 . (15.г)
. (15.г)
В этом случае на поверхности металла образуется нерастворимая оксидная плёнка. Иными словами металл может быть растворимым анодом, а может быть нерастворимым в зависимости от электрохимических условий и состава раствора, то есть, изменяя состав раствора и электрохимические условия, можно управлять этим процессом. В некоторых случаях целесообразно достигать условий, при которых анод нерастворим, в других же, например, при травлении металлов и полупроводников или электрохимической размерной обработке (ЭХРО), необходимо создание условий для растворения анода.
Очень интересен случай, когда для одного и того же металла, в одних и тех же электролитах при определённых условиях металл не растворяется, а при других происходит его интенсивное анодное растворение. Иными словами, в электрохимических системах процессом растворения анода или его пассивацией можно управлять.
Очень важным процессом, широко распространённым в природе явлением, является процесс взаимодействия металла с компонентами окружающей среды. Этот процесс приводит к самопроизвольному разрушению металла, которое называется коррозией. Коррозия в общем случае является электрохимическим процессом, а, следовательно, методы борьбы с коррозией должны быть, в том числе и электрохимическими.
Первой теорией коррозии была теория, разработанная известным итальянским физиком Де ла Ривом. Согласно этой теории определяющую роль в процессе коррозии металла играют примеси, поскольку было замечено, что технические металлы, содержащие большое количество примесей, существенно в большей степени подвергаются коррозии, чем абсолютно чистый металл.
В дальнейшем мы рассмотрим роль легирующих компонентов и примесей в процессе коррозии и покажем, что при их наличии коррозия действительно усиливается, но наличие примесей не является основной причиной и движущей силой коррозии. В настоящее время общепринятой является кинетическая теория коррозии, объясняющая коррозионные процессы кинетическими закономерностями растворения металлов (окисления) и восстановления компонентов растворителя (окислителя).
Дата добавления: 2017-01-29; просмотров: 1023;
