Диффузия и осмос в растворах
Явление диффузии можно наблюдать при проведении следующего опыта. Если в стакан с окрашенным раствором какого-либо вещества осторожно налить растворитель, то вначале между слоями раствора и растворителя будет наблюдаться четкая граница раздела. Постепенно граница раздела размывается, и через некоторое время весь объем жидкости приобретет равномерную окраску. Это происходит в результате диффузии.
Диффузия– самопроизвольный перенос вещества из области с большей концентрацией в область с меньшей концентрацией.
В приведенном примере растворенное вещество диффундирует в слой чистого растворителя, а молекулы растворителя переходят в слой раствора – этот процесс двусторонней диффузии заканчивается выравниванием концентрации во всем объеме.
Скорость диффузии измеряется количеством вещества, перенесенным за единицу времени через единицу площади. Она пропорциональна разности концентраций в двух слоях жидкости и температуре. Чем больше разность концентраций и чем выше температура, тем скорость диффузии больше. По мере выравнивания концентрации скорость диффузии уменьшается.
Диффузия может идти в том случае, если между слоем раствора и слоем растворителя поместить полупроницаемую перегородку – мембрану. Полупроницаемыми перегородками для водных растворов могут служить природные пленки, стенки клеток, а также пленки, полученные искусственным путем (целлофан, пергамент). Через эти пленки могут проходить маленькие молекулы растворителя и не проходят более крупные молекулы растворенных веществ.
Односторонняя диффузия растворителя в раствор через полупроницаемую перегородку называется осмосом.
Объем раствора в результате осмоса увеличивается, при этом возникает давление на стенки сосуда, в котором находится раствор. Это давление называется осмотическим. Осмотическое давление может быть оценено давлением столба жидкости в вертикальной трубке над уровнем раствора. Этот прибор может служить для определения осмотического давления и называется осмометром.
На основании опытных данных измерения осмотического давления растворов при различных температурах и концентрациях было установлено, что разбавленные растворы хорошо подчиняются законам идеальных газов.
Это сходство разбавленных растворов с идеальными газами впервые было замечено Вант-Гоффом и приобрело статус закона:
Эта зависимость выражается уравнением Вант-Гоффа:
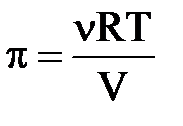 , (4.4)
, (4.4)
где p – осмотическое давление,
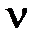 – количество растворенного вещества,
– количество растворенного вещества,
R – универсальная газовая постоянная,
Т – температура,
V – объем раствора.
Осмотическое давление разбавленного раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде газа при этой же температуре занимало тот же объем, что и раствор.
Растворы электролитов имеют более высокое осмотическое давление, чем вычисленное по уравнению. Для таких растворов Вант-Гофф ввел в это уравнение коэффициент i, называемый изотоническим коэффициентом.
Осмос имеет большое значение для процессов жизнедеятельности животных и растений. Процессы усвоения пищи, обмена веществ тесно связаны с различной проницаемостью воды и растворенных веществ через стенки клеток живых организмов. Осмос обусловливает поднятие воды по стеблю растений, рост клетки и многие другие явления. Если поместить клетку в раствор, концентрация которого равна концентрации клеточного сока, то состояние клетки не изменится, так как осмотическое давление в клетке и в растворе одинаково. Такие растворы, имеющие одинаковое осмотическое давление называются изотоническими.
В крепких солевых растворах наблюдается сморщивание клеток (плазмолиз), обусловленное потерей воды, уходящей из клеток в более концентрированный внешний раствор. При этом осмотическое давление внешнего раствора выше, чем внутри клетки, и раствор называется гипертоническим. Если же поместить клетку в раствор, концентрация которого будет ниже концентрации клеточного сока, то происходит всасывание воды в клетку. Объем клетки увеличивается, и клетка находится в состоянии напряжения (тургора). Это явление объясняется более низким осмотическим давлением внешнего раствора, который называют гипотоническим.Осмос играет большую роль в жизни всех организмов. Осмотическое давление в крови, лимфе и тканях человека достигает 7,7 атм (0,8 МПа).
Такое же давление имеет 0,9 % раствор хлорида натрия. Такой раствор называют физиологическим, он часто служит основой для лекарств, вводимых в организм инъекцией. Организм человека обладает способностью поддерживать осмотическое давление на постоянном уровне. При изменении осмотического давления организм стремится восстановить его. Так, при введении в организм с пищей соли или сахара осмотическое давление изменяется. Чтобы привести его в норму, появляется чувство жажды.
Широко известно применение больших концентраций сахара или соли для консервирования пищевых продуктов. В этих условиях из-за высокой концентрации раствора микроорганизмы подвергаются плазмолизу и становятся нежизнеспособными.
Дата добавления: 2017-01-29; просмотров: 3783;
