Ионные равновесия в водных растворах. Количественное определение кислотности водных растворов. Понятие pH и pK. Гидролиз солей. Буферные растворы. Произведение растворимости.
Благодаря теории электролитической диссоциации удалось определить, что такое кислота и что такое основание, а также количественно рассчитать степень кислотности растворов.
Из теории электролитической диссоциации следует, что кислота - это химическое соединение, которое в водном растворе диссоциирует с образованием ионов гидроксония (H3O+ - гидратированных ионов водорода, которые в дальнейшем будут обозначаться просто H+) (5.а). Основание это соединение, диссоциирующее в водном растворе с образованием гидроксил - ионов (5.б).
HClO3 + H2O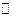 H3O+ +
H3O+ + 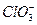 (5.a)
(5.a)
KOH 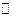 K+ + OH- (5.б)
K+ + OH- (5.б)
Отсюда следует, что в зависимости от того, что преобладает в растворе ионы гидроксония или ионы гидроксила раствор будет кислотой или щелочью соответственно.
Я.Бренстед в 1923 году осуществил обобщение теории С.Аренниуса. По его определению кислота - это донор протонов, а основание - акцептор. Например, в реакции (5.а) HClO3 – кислота, а H2O– основание. Более того, можно записать:
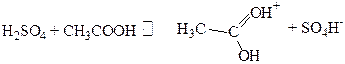 (5.в)
(5.в)
Из реакции (5.в) очевидна относительность понятия кислоты и основания. В реакции (5.в) CH3 COOHявляется основанием, а при взаимодействии с водой CH3COOHбудет кислотой.
CH3 COOH + H2O 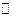 H3O+ + CH3 COOH-(5.г)
H3O+ + CH3 COOH-(5.г)
Из вышеизложенного видно, что необходима количественная характеристика силы кислоты и основания. Для получения этих характеристик рассмотрим для примера только водные растворы.
Запишем реакцию диссоциации воды:
H2O 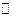 H++OH- (5.д)
H++OH- (5.д)
Применяя к этому уравнению закон действующих масс, можно записать:
Kd= 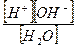 (5.1)
(5.1)
Известно, что при 25°C Kd= 3,24×10-18, 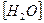 = 1000/18 = 55,5 моль/л (концентрация “воды в воде”). Тогда:
= 1000/18 = 55,5 моль/л (концентрация “воды в воде”). Тогда:
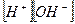 = Kd×
= Kd× 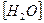 = Kив = 3.24×10-18×55,5 моль/л » 10-14 моль/л
= Kив = 3.24×10-18×55,5 моль/л » 10-14 моль/л
Константа Kив носит название ионное произведение воды.
Считая, что 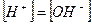 получаем:
получаем:
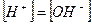 = 10 -7 моль/л (5.2)
= 10 -7 моль/л (5.2)
В 1920 г. Я. Соренсен ввёл понятие pH
pH = -lg [H+]. (5.3)
Учитывая уравнения (5.2) и (5.3), получаем при равенстве концентраций ионов водорода и гидроксила, что pH = 7.
Аналогично pH можно ввести понятие pOH:
pOH = - lg [OH-], (5.4)
Тогда очевидно, что:
pH + pOH= 14(5.5)
Для кислой среды pH < 7,для щелочной pH > 7, а в нейтральной среде pH = 7.
Для диссоциации кислоты можно записать аналогичное соотношение. Запишем его в общем виде:
AH 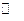 A- + H+ (5.ж)
A- + H+ (5.ж)
Для данного уравнения запишем закон действующих масс:
Ka= 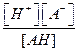 ,(5.з)
,(5.з)
где Ка– константа диссоциации кислоты.
Введем понятиеpKа -отрицательного логарифма константы ионизации кислоты:
pKа = - lgKa (5.6)
Если константа ионизации кислотыстремится к бесконечности, то есть кислота полностью диссоциирует, то pK® - ¥.Для сильных кислот pKаотрицательно и чем больше его отрицательное значение, тем выше сила кислоты.
таблица 5.1
Значения pKа некоторых кислот
| Кислота | Константа диссоциации | pKa |
| HClO4 (хлорная) | Ka » 108 | pKa = - 8 |
| HCl (соляная) | Ka » 103 | pKa = - 3 |
| HNO3 (азотная) | Ka » 102 | pKa = - 2 |
| HNO2 (азотистая) | Ka » 4×10-4 | pKa = 3,4 |
| HCN (синильная) | Ka » 4×10-10 | pKa » 9,4 |
Рассмотрим поведение слабых кислот  в растворе.
в растворе. 

 Учитывая закон разведения В. Оствальда применительно к слабой кислоте (4.11) и (4.12), можно записать, что:
Учитывая закон разведения В. Оствальда применительно к слабой кислоте (4.11) и (4.12), можно записать, что:
[H+] = Caa (5.7)
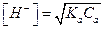 (5.8)
(5.8)
Из (5.8) следует, что кислотность слабых кислот связана с константами их диссоциации. Учитывая уравнение (5.3), можно записать, что для слабой кислоты:
pH = 0,5pKа – 0,5lgCa, (5.9)
аналогично для слабого основания с учетом (5.5):
pH = 14 – 0,5pKb + 0,5lgCb, (5.10)
Kа, Kb, Ca, Cb – константы диссоциации и концентрации кислот и оснований соответственно.
Значения Kaи Kb приводятся в справочниках. По уравнениям (5.9) и (5.10) можно рассчитывать pHслабых кислот и оснований. Для сильных кислот и оснований необходимо использовать уравнения (5.3) - (5.5).
Гидролиз солей.
Гидролиз солей - это взаимодействие солей с водой. В зависимости природы соли, т.е. какой кислотой и основанием (по силе) она образована, при растворении соль будет давать разную pH среды (кислотную, щелочную или нейтральную).
Рассмотрим вначале процесс гидролиза хлорида аммония. При этом учтём, что все соли диссоциируют полностью, а вода является слабым электролитом.
NH4Cl 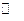
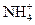 + Cl–
+ Cl–
H2O 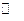 OH- + H+
OH- + H+
¯
NH4Cl + H2O 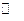 NH4OH+
NH4OH+ 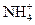 + Cl– + H+
+ Cl– + H+
¯ ¯(pH < 7)
(малодиссоциирующее соединение) (избыток ионов водорода)
Таким образом, соль сильной кислоты и слабого основания при гидролизе всегда будет создавать кислую среду.
Рассмотрим другой пример – соль, образованная сильным основанием и слабой кислотой:
CH3COONa 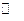 CH3COO-+ Na+
CH3COO-+ Na+
H2O 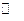 H+ + OH–
H+ + OH–
¯
CH3 COO Na + H2O 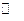 CH3 COOH + Na+ + OH–
CH3 COOH + Na+ + OH–
¯ ¯(pH > 7)
(малодиссоциирующее соединение) (избыток ионов гидроксила)
То есть соль слабой кислоты и сильного основания всегда будет давать при растворении щелочную реакцию.
Соль же сильной кислоты и сильного основания, слабой кислоты и слабого основания при своём растворении будет давать среду, зависящую от соотношения силы кислоты и силы основания.
pH при гидролизе можно рассчитать для:
соли сильной кислоты и слабого основания
pH = 7 – 0,5pKb – 0,5lgCab;(5.11)
соли слабой кислоты и сильного основания
pH = 7 + 0,5pKа + 0,5lgCab; (5.12)
соли слабой кислоты и слабого основания
pH = 7 + 0,5pKа - 0,5pKb, (5.13)
где Cab концентрация растворенной соли.
Согласно (5.13) pHпри гидролизе соли слабой кислоты и слабого основания зависит только от константы диссоциации (ионизации) кислоты и основания, и не зависит от концентрации соли.
Буферные растворы.
Рассмотрим смесь слабой кислоты и ее соли, образованной сильным основанием. Например, смесь водных растворов уксусной кислотыи ацетата натрия. Запишем реакцию диссоциации кислоты:
CH3COOH 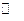 CH3COO- + H+. (5.и)
CH3COO- + H+. (5.и)
Тогда 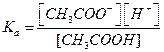 , (5.14)
, (5.14)
откуда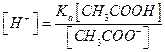 .(5.15)
.(5.15)
Обозначим: 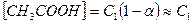 (a <<1, слабая кислота) и концентрацию ацетат – ионов через C2, тогда
(a <<1, слабая кислота) и концентрацию ацетат – ионов через C2, тогда 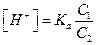 . Подставляя полученное уравнение в (5.3), получаем:
. Подставляя полученное уравнение в (5.3), получаем:
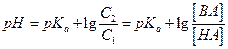 (5.16)
(5.16)
Аналогично для слабого основания и его соли, образованной сильной кислотой, получим:
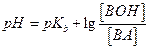 (5.17)
(5.17)
Рассмотрим свойства уравнений (5.16) и (5.17)
1. pH раствора не зависит от разбавления (уменьшения концентрации). При разбавлении в одинаковой степени будет меняться концентрация соли и кислоты, а, следовательно, pH раствора остается постоянным;
2. если взять высокую концентрацию соли и кислоты, то небольшое изменение кислотности не будет сказываться на величине pH. Аналогично для уравнения (5.17) при высокой концентрации основания и его соли изменение основности раствора не будет сказываться на значении pH.
Растворы, pH которых мало зависит от вносимых изменений концентраций ионов водорода (гидроксила) называются буферными растворами. Они представляют собой смеси слабой кислоты и ее соли, образованной сильным основанием или смесь слабого основания и его соли, образованной сильной кислотой.
Существуют буферные растворы, позволяющие поддерживать постоянство практически любых значений pH (как кислых, так и щелочных).
Дата добавления: 2017-01-29; просмотров: 3491;
