Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
В концентрированных растворах электролитов необходимо учитывать взаимодействие ионов друг с другом. Именно это приводит к тому, что как бы снижается их концентрация. П.Дебаю и независимо от него Х.Гюккелю в 1923г. удалось на основе учета ион - ионного взаимодействия рассчитать средний коэффициент активности
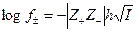 , (4.16)
, (4.16)
где
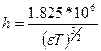 (4.17)
(4.17)
Уравнение (4.16) верно для 1 - 1 валентного электролита. Для более сложных случаев была получена эмпирическая формула Я.Бренстеда:
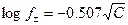 (4.18)
(4.18)
В некоторых случаях можно использовать формулу Х.Гютельберга
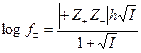 (4.19)
(4.19)
Теория Дебая – Гюккеля, таким образом, описывает ион – ионное взаимодействие в сильных электролитах и часто носит название теории сильных электролитов. Как видно из соотношений (4.16) – (4.19) теория Дебая – Гюккеля позволила рассчитать для некоторых частных случаев коэффициент активности, который объяснял ион – ионное взаимодействие, снижающее эффективную концентрацию частиц в растворах, учитывая и диэлектрическую проницаемость растворителя (e) и общую ионную силу раствора (I).
Вопросы и задачи
Пример 1.
Образование йодистого водорода протекает по реакции
H2 + J2 = 2HJ
Исходная концентрация водорода равна 1 моль/л, а йода – 0,6 моль/л. Рассчитать концентрации всех трех веществ в момент равновесия, если при некоторой температуре в реакцию вступило 50% водорода. Чему равна константа равновесия?
РЕШЕНИЕ. Из уравнения реакции видно, что вследствие взаимодействия одного моля Н2 с одним молем J2 образуется 2 моля HJ. По условию задачи, в реакцию вступило 50% исходной концентрации Н2, т.е. 0,5 моль/л Н2 и столько же молей J2, при этом образовался 1 моль НJ.
Следовательно, в момент равновесия, концентрации веществ были равны:
[H2]=1 моль/л – 0,5 моль/л = 0,5 моль/л
[J2]= 0,6 моль/л – 0,5 моль/л = 0,1 моль/л
[HJ]= 1 моль/л
Константу равновесия рассчитывает по уравнению, являющемуся следствием закона действующих масс:
К = 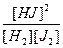 = 1/0,5·0,1 = 20
= 1/0,5·0,1 = 20
Пример 2.
Кажущаяся степень диссоциации раствора, содержащего 2,925 г NaCl в 50 г воды, равна 0,80. Найти температуру замерзания раствора.
РЕШЕНИЕ. Находим изотонический коэффициент i соли, приходящееся на 1000 г воды, из пропорции: 2,925:50 = х:1000; х = 58,5. Это – вес одной грамм-молекулы NaCl. По определению, ΔT = КС (1), где ΔT – понижение температуры замерзания раствора, С – концентрация (моляльная) растворенного вещества в молях на 1000 г растворителя. Из уравнения (1) видно, что когда С = 1, ΔT = К, т.е. К есть коэффициент пропорциональности для данного растворителя. Для воды он равен 1,86оС. Коэффициент К в уравнении (1) называют криоскопической постоянной.
Фактически ΔT зависит от коэффициента i, который можно найти из уравнения (4.4) 0,80 = i - 1/ 2-1; i = 1,8, отсюда ΔT = iКС и ΔT = 1,86·1,8 = 3,37о. Значит температура замерзания раствора NaCl = -3,37оС.
1. В обратимой реакции А + B = С + D исходные концентрации А и B равны 1 моль/л, а константа равновесия К = 5. Вычислить равновесные концентрации А и B.
2. Вычислить константу химического равновесия для обратимой реакции А + B = 2С, если равновесная концентрация равна [А] = [B] = 0,1 моль/л, [С] = 0,4 моль/л.
3. Равновесие реакции 2NO + О2 = 2NO2 установилось при следующих концентрациях веществ: [NO] = 1,12 моль/л, [О2] = 0,56 моль/л, [NO2] = 0,88 моль/л. Рассчитать константу равновесия и исходные концентрации окиси азота и кислорода.
4. Раствор 1,7 г ZnCl2 в 250 г воды замерзает при температуре – 0,24оС. Вычислить степень диссоциации соли.
5. Определить уксусная кислота сильный или слабый электролит, если раствор, содержащий 0,57 г кислоты в 100 г воды, замерзает при температуре – 0,181оС.
6. Температура замерзания раствора 2,93 г NaCl в 50 г воды – 3,35оС. Определить степень диссоциации.
Дата добавления: 2017-01-29; просмотров: 1386;
