Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
На предыдущих лекциях мы смогли убедиться на опыте (гальванический элемент), что в окислительно-восстановительных реакциях действительно переносятся электроны. Кроме того, мы дали определение равновесного потенциала и вообще равновесия. В условиях равновесия по данным внешнего баланса нет тока. Но существуют ли заряженные частицы, ионы в растворе в отсутствие тока?
Ведь буквально слово “электролит” означает разлагаемый электричеством (перевод с греч.). Этот термин принадлежит М.Фарадею, который считал, что разложение на ионы происходит только в результате действия электрического тока. Поэтому возникает важный вопрос: В чем природа проводимости электролитов? Существуют ли носители заряда в растворе или они возникают под действием электрического тока?
Первой теорией, объясняющей возникновение ионов в растворе, была теория литовского ученого Т.Гроттгуса (1805г). Он предложил так называемый “эстафетный механизм” возникновения зарядов (рис. 4.1). Благодаря реакции на границе и удалению положительно заряженного иона, на катоде возникает избыток отрицательного заряда, благодаря которому происходит разделение зарядов у близлежащих молекул и т.д. по эстафете. Но это означает, что разделение зарядов происходит только под действием тока, а в растворе заряды отсутствуют.
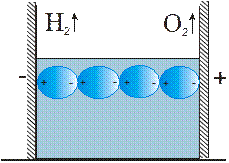
Рис. 4.1 “Эстафетный механизм ” возникновения зарядов в растворе.
Вторая гипотеза принадлежит М.Фарадею: молекулы растягиваются под действием электрического поля и так происходит их диссоциация, разложение.
Однако в дальнейшем оказалось, что это неверно: частично или полностью разложение происходит и без электрического тока, т.е. при растворении. Как это доказать?
При изучении растворов электролитов в середине XIX века был обнаружен ряд отклонений от законов разбавленных растворов:
1. изменение осмотического давления[*] 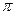 подчиняется следующему уравнению.
подчиняется следующему уравнению.
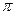 = CRT,(4.1)
= CRT,(4.1)
гдеC – концентрация раствора; R – универсальная газовая постоянная; Т– абсолютная температура.
Измерения показывали, что, например, осмотическое давление раствора сахара в воде описывалось этим соотношением. Однако применение уравнения (4.1), к водным растворам солей, например, к раствору NaCl, предполагало значительно более низкое значение p,чем получалось в эксперименте. Известный голландский ученный Я.Вант - Гофф предложил вводить поправочный коэффициент, названный изотоническим. Тогда для этих растворов можно записать соотношение (i > 1):
p= iCRT (4.2)
Получалось, что в таких растворах как будто бы большее число частиц.
2. Изменение давления пара растворителя над раствором неэлектролитов можно рассчитать следующим образом:
Dp= 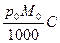 ,(4.3)
,(4.3)
где р0 – это давление пара над чистым растворителем; М0- молекулярная масса растворителя; С – моляльная концентрация раствора.
Опять же для растворов электролитов совпадение экспериментальных данных и расчетных по уравнению (4.3) возможно было только в том случае, если вводился изотонический коэффициент i >1.
3.Изменение температур кипения и замерзания.Криоскопические и эбулиоскопические измерения (это измерения понижения температуры замерзания и повышения температуры кипения растворов по сравнению с чистыми растворителями), показали, что в растворах электролитов экспериментально измеренное понижение температуры замерзания и повышение температуры кипения оказались завышенными по сравнению с расчетными.
Подобные отклонения для растворов электролитов смогла объяснить теория шведского ученного С. Аррениуса, разработанная только в 1887г. Она позволила количественно показать природу процессов, протекающих в растворах электролитов. В основном эта теория сохранила свое значение до настоящего времени.
Дата добавления: 2017-01-29; просмотров: 1428;
