Электрохимический эквивалент сплава и практический
Электрохимический эквивалент.
Электрохимической обработке часто подвергаются не чистые металлы, а их сплавы. В этом случае электрохимический эквивалент подсчитывается с использованием метода “сложения зарядов”:
C = (F  xk nk/Mk) -1, (2.12)
xk nk/Mk) -1, (2.12)
где l – число компонентов в сплаве, а xk, nk, Mk – массовая доля, число переносимых электронов и атомная масса k – того компонента сплава.
Например, для сплава, содержащего 20% хрома и 80% железа величина xFe = 0,8, а xCr = 0,2, MFe и MCr равны 59 и 52 соответственно (атомные массы железа и хрома), l = 2 (число компонентов сплава), величины nFe и nCr определяются степенью окисления железа и хрома в продуктах растворения.
Часто в практике электрохимической обработки используются т.н. “практический электрохимический эквивалент”, представляющий собой произведениеεC.Это произведение, будучи подставленным в выражения (2.7) – (2.9) даёт реальную скорость обработки. Например:
Vi = 
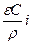 (2.13)
(2.13)
Vv = 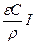 (2.14)
(2.14)
Vm = 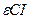 (2.15)
(2.15)
Очевидно, что выражения (2.7) – (2.9) представляют собой частные случаи (2.13) –(2.15) при ε= 1 (100% выходе по току).
Вопросы и задачи
- Рассчитать электрохимический эквивалент титана, если при его анодном растворении титан ионизируется в виде Ti+4 (Ti ® Ti+4 + 4
 )
) - Рассчитать электрохимический эквивалент хрома, если хром ионизируется в высшей степени окисления
- Рассчитайте электрохимический эквивалент сплава Ni – Cr с одинаковым весовым содержанием никеля и хрома в сплаве, если никель растворяется до Ni(II), а хром до своей высшей степени окисления.
- Определить выход по току растворения сплава Fe – Cr, если растворение железа происходит до высшей степени окисления, а хрома до степени окисления +3. В растворе после растворения сплава током 100А в течение 100с обнаружено 0,5г хрома и 0,5г железа (растворение было равномерным).
- Определить эффективную валентность растворения железа, если после пропускания тока в 1000А в течение 2 часов в раствор перешло 2 кг железа.
- Сколько времени необходимо затратить, чтобы растворить слой вольфрама толщиной 0,1 мм с поверхности 100 см2 током 100А, если растворение вольфрама происходит в высшей степени окисления с выходом по току 100%?
- Определить линейную скорость (мм/мин) растворения стальной пластины (сталь содержит 18% (вес) хрома) площадью 10см2, если в системе поддерживается ток в 1000А, железо растворяется с образованием ионов Fe+2, а хром - с образованием бихромат-ионов. Плотность стали линейно изменяется с содержанием хрома в стали.
- Определить линейную скорость хромирования (мм/час) детали общей площадью 1 м2, если в ванне поддерживается ток в 1000 А, а осаждение идет из раствора, содержащего бихромат-ионы с выходом по току 95%.
- Рассчитайте линейную скорость обработки (мм/мин) детали из хрома общей площадью 100 см2 током 5 кА, если выход по току растворения хрома равен 100%.
- Какой источник тока необходим (исходя из максимального тока источника), чтобы обеспечить обработку стали с электрохимическим эквивалентом 1 г/А×час для прошивки полости общей поверхностью 100 см2 со скоростью 1 мм/мин?
Дата добавления: 2017-01-29; просмотров: 2360;
