Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
Электрохимические реакции – это гетерогенные химические реакции, протекающие на границе раздела различных фаз, сопровождающиеся переносом зарядов через эту границу.
Все электрохимические реакции при своей записи должны содержать в левой или правой части электроны, потому что происходит их перенос при протекании реакции.
Первое, что необходимо знать - это скорость реакции:
Vm = d∆m/dt, (2.1)
гдеVm-количество вещества, перешедшее через границу в единицу времени.
Обозначим через N число ионов, перешедших в раствор, а через Q - полный заряд иона, получающегося в результате реакции
Ме  Ме +n+n
Ме +n+n  , (2.а)
, (2.а)
где  - элементарный заряд, заряд электрона. Тогда
- элементарный заряд, заряд электрона. Тогда
N = Q/ne. (2.2)
Учитывая, что масса иона а равна атомной массе М, деленной на число Авогадро Na, получим:
∆m = aN =MQ/Na n  (2.3)
(2.3)
Произведение Na  – это произведение двух фундаментальных постоянных (числа Авогадро и заряда электрона). Это произведение носит название константы Фарадея F = 96500 Кл/моль = 26,8 А·час/моль.
– это произведение двух фундаментальных постоянных (числа Авогадро и заряда электрона). Это произведение носит название константы Фарадея F = 96500 Кл/моль = 26,8 А·час/моль.
Тогда:
∆m = 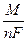 Q =
Q = 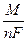 It, (2.4)
It, (2.4)
где I - ток, t - время, Q - количество электричества. Уравнение (2.4) представляет собой т.н. объединенный закон Фарадея.
Масса вещества, перешедшая в раствор (или выделившаяся на катоде) пропорциональна заряду, прошедшему через систему:
∆m = CQ (2.5)
C = 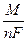 (2.6)
(2.6)
Величина С носит название электрохимического эквивалента (размерность г/Кл; г/А час).
Закон Фарадея является простым следствием атомарной природы вещества. Величие этого закона природы в том, что благодаря ему осуществляется связь между микромиром (заряд иона, единичный заряд) и макромиром (вес осадка на электроде, количество прореагировавшего вещества).
Отношение 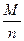 носит название химического эквивалента.
носит название химического эквивалента.
Дата добавления: 2017-01-29; просмотров: 1323;
