Порядок уравнивания окислительно-восстановительных реакций, т.е. приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
Метод электронного баланса
Для расстановки коэффициентов в окислительно-восстановительных реакциях по методу электронного баланса необходимо:
- найти окислитель и восстановитель и записать реакции присоединения и отдачи электронов;
- произвести баланс перенесенных зарядов;
- произвести уравнивание в соответствии с балансом заряда;
- проверить баланс по водороду;
- проверить соблюдения баланса по кислороду.
Например, запишем уравнение реакции получения хлора окислением соляной кислоты перманганатом калия:
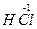 +
+ 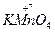 →
→ 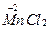 +
+ 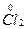 +KCl + H2O
+KCl + H2O
 В этой реакции хлорид-ион окисляясь, отдает один электрон, а Mn+7, восстанавливаясь, принимает пять электронов. Составляем электронные уравнения:
В этой реакции хлорид-ион окисляясь, отдает один электрон, а Mn+7, восстанавливаясь, принимает пять электронов. Составляем электронные уравнения:
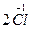 -
- 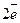 =
= 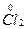 5
5
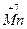 +
+  =
= 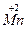 2
2
Полученные коэффициенты подставляем в схему реакции:
HCl + 2KMnO4 → 2MnCl2+5Cl2 + KCl + H2O,
Далее подбираем коэффициенты для кислотных остатков и водорода
16HCl + 2KMnO4 = 2MnCl2+5Cl2 + 2KCl + 8H2O.
Правильность расстановки коэффициентов проверяем по балансу кислорода.
Метод полуреакций (электронно-ионного баланса)
Метод полуреакций удобен при расстановке коэффициентов в ионных окислительно-восстановительных уравнениях. Принципы расстановки сходны с вышеприведенным методом, однако вместо элементов в уравнениях электронного баланса используются ионы. Например, рассмотрим реакцию взаимодействия сульфит- и перманганат-ионов в кислой среде:
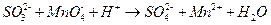
Восстановителем является сульфит-ион (он отдает электроны). Запишем уравнение его окисления (полуреакцию), дополняя недостающий кислород (слева) водой и водород (справа) ионами водорода:
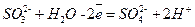
Перманганат-ион служит в этой реакции окислителем (он принимает электроны). Запишем полуреакцию и для него, используя тот же метод дополнения водой и ионами водорода:
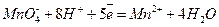
Теперь суммируя полученные полуреакции с учетом равенства отданных и принятых электронов, получаем сокращенное ионное уравнение данной реакции:
 |
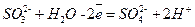 5
5
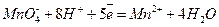 2
2
 |
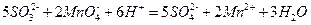
Дополняя левую и правую части уравнения одинаковыми количествами одноименных ионов можно легко перейти к молекулярному уравнению:
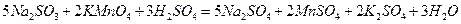
Как видно из рассмотренного выше в окислительно-восстановительных реакциях наблюдается перенос электронов (присоединение в процессе восстановления и отдача при окислении). В связи с этим они играют определяющую роль в электрохимических процессах. Попытаемся доказать, что в окислительно-всстановительных реакциях подобных тем, которые мы рассмотрели выше, действительно наблюдается перенос электронов. Для этого проведем эксперимент, схема которого представлена на рисунке 1.1.
Дата добавления: 2017-01-29; просмотров: 1146;
