Окислительно-восстановительные реакции.
Краткие сведения о развитии электрохимии. Окислительно-восстановительные реакции. Роль электрохимических процессов в обработке металлов и других технологиях.
В 1791 г. итальянский естествоиспытатель Л.Гальвани описал свои опыты по воздействию внешней среды на поведение живых организмов. Он проводил их с использованием в качестве подопытных лягушек. Лягушки прикреплялись одной лапкой к медному крючку, который в свою очередь подвешивался на стальную проволоку. Когда под влиянием внешних воздействий лягушка другой лапкой касалась стальной проволоки, ее сотрясало как будто от электрического разряда. Л.Гальвани сделал вывод, что это поведение является следствием наличия “животного электричества” в лягушке.
А.Вольта, ознакомившись с этим экспериментом, пришел к иному заключению, а именно, что определяющую роль в реакции лягушки играет присутствие в исследуемых опытах разных металлов: меди и стали, а лягушка только играет роль проводника. Для доказательства своей гипотезы он изготовил “батарею” из пластин меди и цинка, и каждую из пластинок отделил от другой прослойкой из материи, смоченной серной кислотой. На концах такой “батареи” (названой впоследствии “вольтовым столбом”) возникала разность потенциалов (напряжение) столь большой величины, что на ее полюсах появлялся искровой разряд. Так был создан первый источник электрического тока.
Создание первого источника электрического тока ознаменовало собой начало исследований в области электричества, а затем и магнитных явлений. Именно с электрохимии началось развитие науки об электричестве и магнетизме, (М. Фарадей. Г. Ампер. Дж. Джоуль), которое завершилось созданием знаменитых уравнений Дж. Максвелла, объединяющих описание электрических и магнитных явлений.
“Из совокупности всех проявлений электричества электролиз больше всего способствует получению реальных представлений о природе электрического тока, так как здесь потоки вещества и потоки зарядов – части одного и того же явления”.
Дж. К. Максвелл “Руководство по электричеству и магнетизму” т. 1. 1873г.
Окислительно-восстановительные реакции.
Рассмотрим уравнения следующих реакций:
FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl (1.а)
HCl + NaOH = H2O + NaCl (1.б)
Fe + 2HCl = FeCl2 + H2 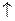 (1.в)
(1.в)
Fe + CuSO4 = FeSO4 + Cu (1.г)
Реакции (1.в), (1.г) отличаются от двух других тем, что в них происходит изменение степени окисления компонентов. Такие реакции называются окислительно-восстановительными.
Одним из наиболее фундаментальных законов природы является закон сохранения энергии. Его проявление в окислительно-восстановительных реакциях заключается в том, что в них помимо закона сохранения массы, наблюдающегося в любых химических реакциях, должен соблюдаться закон сохранения заряда. Закон сохранения заряда в окислительно-восстановительных реакциях проявляется в изменениях степеней окисления элементов, участвующих в ней.
Любое повышение степени окисления называется окислением, а любое понижение степени окисления - восстановлением. (Окисление - oxidation (англ.), восстановление – reduction(англ.), окислительно-восстановительные реакции – redox reactions.)
В окислительно-восстановительных реакциях происходит перенос заряда, а единичным зарядом является электрон, т.е. имеет место перенос электрона. Из закона сохранения заряда следует, что суммарная величина заряда реакции равна нулю.
Fe  Fe2+ + 2
Fe2+ + 2  (1.д)
(1.д)
Cu2+ + 2 
 Cu (1.е)
Cu (1.е)
Fe + Cu2+  Fe2+ +Cu (1.ж)
Fe2+ +Cu (1.ж)
| Перенос электрона в ходе redox реакции | Изменение степени окисления | |
| Окисление Восстановление Восстановитель Окислитель | Потеря электронов Захват электронов Донор электронов Акцептор электронов | Увеличение степени окисления Уменьшение степени окисления Увеличение степени окисления Уменьшение степени окисления |
Дата добавления: 2017-01-29; просмотров: 1061;
