Лекция 13 Закономерности электродных процессов в условиях медленной химической реакции.
Электрохимические процессы в условиях медленной гомогенной химической реакции. Кинетические и каталитические токи электрохимических процессов. Критерии определения природы лимитирующей стадии.
Теория двойного слоя, диффузионная кинетика (физико-химическая гидродинамика, ионный массоперенос), теория стадии разряда - ионизации, а также закономерности образования новой фазы являются той основой, на которой базируется современная электрохимическая кинетика. Однако даже электродные процессы, при которых наблюдается сочетание диффузионной стадии и стадии разряда-ионизации относятся к числу простых электрохимических процессов. Так, например, в наиболее изученном процессе реакции выделения водорода одной из замедленных стадий может быть не электрохимическая реакция или конвективная диффузия, а химическая реакция.
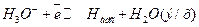 (13.а)
(13.а)
 (13.б)
(13.б)
Из (13.а) и (13.б) следует, что замедленной стадией в суммарной реакции выделения газообразного водорода является именно стадия химической реакции (13.б).
Ниже будут рассмотрены общие закономерности электродных процессов, в которых замедленной является стадия химической реакции. Вариантов может быть несколько:
1. замедленность гетерогенной химической реакции, при которой медленной является последующая после электрохимической стадии химическая (в качестве примера это реакция (13.б));
2. замедленной является предшествующая электрохимическому процессу стадия химической реакции;
3. предшествующая электрохимической стадии, стадия гомогенной химической реакции;
4. последующая после электрохимической стадии, стадия гомогенной химической реакции является замедленной;
К этой же категории процессов относятся кинетические и каталитические токи, определяющие скорость общего электродного процесса.
Следует подчеркнуть, что все остальные стадии будут при этом равновесными, т.е. потенциал электрода может быть рассчитан с использованием уравнения Нернста, но значение поверхностной концентрации будет отличаться от равновесного значения, характерного для объёма раствора, и будет определяться скоростью соответствующей химической реакции.
Есть общее, что объединяет диффузионные и электродные процессы с замедленной химической реакцией. Это градиент концентраций между поверхностью электрода и объёмом раствора. Поэтому поляризация (перенапряжение) такого рода обычно называется концентрационной поляризацией или перенапряжением. Таким образом, концентрационная поляризация (перенапряжение) обусловлена тем, что на поверхности раздела и в объёме раствора концентрация электроактивного компонента различна, но природа этого различия неодинакова.
В случае диффузионного перенапряжения разница концентраций определяется малой скоростью диффузии (конвективной диффузии), в другом случае замедленностью скорости химической реакции, предшествующей или следующей после электрохимической:
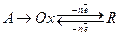 (13.в)
(13.в)
Медленной стадией в реакции (13.в) является предшествующая электрохимическому процессу химическая реакция. То, что она медленная следует из самой формальной записи реакции (13.в) (стрелка только в одну сторону, что свидетельствует о том, что эта реакция является практически необратимой). Возможен также и второй вариант:
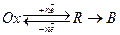 (13.г)
(13.г)
Из сопоставления реакций (13.в) и (13.г) следует, что закономерности катодного процесса с замедленной предшествующей химической реакцией должны полностью соответствовать закономерностям анодного процесса с замедленностью последующей химической реакции. Это следует из симметричности уравнений (13.в) и (13.г). К этим же процессам относятся и каталитические процессы, описываемые уравнениями (13.д):
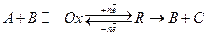 (13.д)
(13.д)
В реакции (13.д) вещество В является катализатором и малая скорость его образования из вещества R будет определять общую скорость реакции. Во всех этих случаях величина потенциала может быть рассчитана по уравнению Нернста.
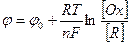 (13.1)
(13.1)
С целью получения обобщённой зависимости для замедленной химической реакции, определяющей общую скорость электродного процесса, рассмотрим следующую химическую реакцию:
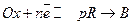 (13.е)
(13.е)
Это электрохимическая реакция восстановления окислителя Ox, за которой следует химическая реакция превращения восстановителя R в вещество B; p - порядок реакции.
Порядок реакции - это степень влияния концентрации на скорость реакции. Например: для всех диффузионных процессов характерна линейная зависимость скорости реакции от концентрации 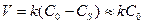 при
при 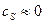 . Очевидно, что в этом случае порядок реакции p =1. В тех случаях, когда отсутствует зависимость скорости реакции от концентрации порядок реакции p =0.
. Очевидно, что в этом случае порядок реакции p =1. В тех случаях, когда отсутствует зависимость скорости реакции от концентрации порядок реакции p =0.
В общем случае порядок реакции не обязательно должен быть целочисленным. Обозначим скорость прямой реакции превращения R в B, как 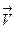 , а скорость обратной реакции
, а скорость обратной реакции 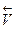 . Из уравнения (13.г) следует, что:
. Из уравнения (13.г) следует, что:
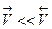 (13.2)
(13.2)
Поскольку именно реакция превращения R в B является лимитирующей стадией и определяет общую скорость реакции, можно записать:
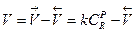 (13.3)
(13.3)
Обозначим через 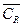 равновесную концентрацию вещества R. В условиях равновесия:
равновесную концентрацию вещества R. В условиях равновесия:
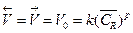 (13.4)
(13.4)
Если имеет место избыток вещества В, то есть обратная реакция (13.е) является быстрой, то можно записать:
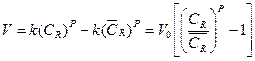 (13.5)
(13.5)
Чтобы перейти от скорости химической реакции к плотности тока, необходимо воспользоваться диффузионным уравнением, отражающим баланс вещества R.
 (13.6)
(13.6)
В стационарных условиях:
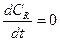
 (13.7)
(13.7)
откуда
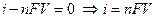 , (13.8)
, (13.8)
тогда:
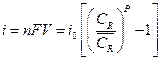 , (13.9)
, (13.9)
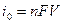
 (13.10)
(13.10)
где 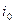 -плотность тока обмена при замедленной химической реакции.
-плотность тока обмена при замедленной химической реакции.
Поскольку при замедленной химической реакции для потенциала мы можем использовать уравнение Нернста, запишем:
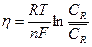 (13.11)
(13.11)
Подставив 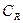 из (13.9) в (13.11), получаем:
из (13.9) в (13.11), получаем:
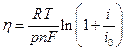 (13.12)
(13.12)
Уравнение (13.12) представляет собой выражение для поляризационной кривой при замедленности скорости химической реакции.
Рассмотрим свойства уравнения (13.12).
А. При малых катодных перенапряжениях примем, что 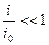 и, заменяя логарифм численным отношением, получим:
и, заменяя логарифм численным отношением, получим:
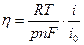 (13.13)
(13.13)
То есть при малых катодных перенапряжениях наблюдается линейная зависимость плотности тока от перенапряжения, а наклон этой зависимости будет определяться скоростью электрохимической реакции и порядком реакции р (см. уравнение (13.13)).
Б. При больших катодных перенапряжениях считая, что 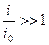 получим:
получим:
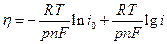 (13.14)
(13.14)
Уравнение (13.14) - это аналог тафелевской зависимости, в котором роль коэффициента переноса 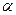 играет порядок реакции;
играет порядок реакции;
В. При больших анодных перенапряжениях, плотность тока не может превысить плотность тока обмена, то есть 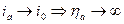 .Фактически это объясняет следующую зависимость плотности тока от перенапряжения (рис. 13.1).
.Фактически это объясняет следующую зависимость плотности тока от перенапряжения (рис. 13.1).
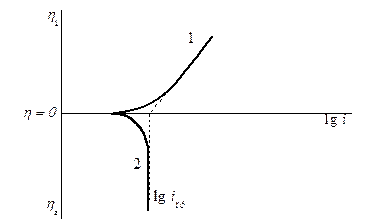
Рис. 13.1 Поляризационная кривая при замедленности химической реакции:
катодная (1) и анодная (2) ветви.
При протекании же катодного процесса с медленной предшествующей химической реакцией, должен наблюдаться предельный кинетический ток 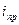 , а при протекании анодного процесса должна наблюдаться тафелевская зависимость и наоборот.
, а при протекании анодного процесса должна наблюдаться тафелевская зависимость и наоборот.
Уравнения (13.13) и (13.14) справедливы, если степень заполнения поверхности веществом R мала. Уравнение Нернста выполняется, если адсорбция вещества на электроде пропорциональна его активности в объёме раствора. Если же степень заполнения 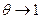 , то при катодном процессе с последующей замедленной химической стадией (соответственно для анодного с предшествующей замедленной стадией) должен наблюдаться предельный кинетический ток. Величина его определяется уравнением изотермы адсорбции вещества R.
, то при катодном процессе с последующей замедленной химической стадией (соответственно для анодного с предшествующей замедленной стадией) должен наблюдаться предельный кинетический ток. Величина его определяется уравнением изотермы адсорбции вещества R.
Уравнение (13.14) впервые было получено И.Тафелем при рассмотрении медленной стадии рекомбинации атомов водорода в реакции его выделения. Поэтому теория Тафеля называется рекомбинационной теорией.
Дата добавления: 2017-01-29; просмотров: 1690;
