Молярная концентрация эквивалентаопределяется числом молярных масс эквивалентов на 1 литр раствора. Эквивалент определяется в соответствии с типом рассматриваемой реакции.
Титр раствора — масса растворённого вещества в 1 мл раствора.
Титриметрический фактор пересчета - масса определяемого вещества в граммах, взаимодействующая с 1 мл титранта.
Титр по определяемому веществу или условный титр — масса какого-либо вещества (в граммах), реагирующая с одним миллилитром данного раствора. Иными словами: масса определяемого вещества, оттитровываемая одним миллилитром раствора.
Поправочный коэффициент F- величина, показывающая, во сколько раз практические концентрации титранта отличаются от соответствующих теоретических значений, заданных в методике.
37. Расчет массы стандартного вещества, необходимой для приготовления титранта.
Массу навески m(А) стандартного вещества А, необходимую для получения раствора с заданной молярной концентрацией эквивалента c(1/zA), рассчитывают по формуле:
m(А) = c(1/zA)*M(1/zA)*V(A) (6)
где M(1/zA) -молярная масса эквивалента вещества А.
Если задается молярная концентрация с(А), то масса навески вычисляется аналогично по формуле:
m(А) = c(A)*M(A)*V(A) (7)
где М(А) - молярная масса вещества А.
Массу навески обычно взвешивают на аналитических весах с ошбкой взвешивания ±0,0002 г.
38. Расчет концентрации титранта при его стандартизации.
Известный объем стандартного раствора объемом 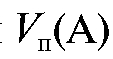 с концентрацией
с концентрацией 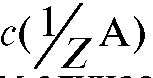 титруют раствором титранта объемом V (Т) (или наоборот). В этом случае для реакции, протекающей в растворе в процессе титрования
титруют раствором титранта объемом V (Т) (или наоборот). В этом случае для реакции, протекающей в растворе в процессе титрования 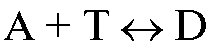 , закон эквивалентов имеет вид:
, закон эквивалентов имеет вид:
и 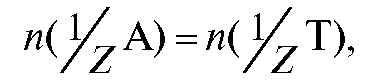
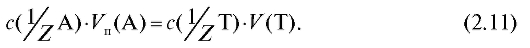
Отсюда получают выражение для расчета молярной концентрации эквивалента титранта по результатам титрования:
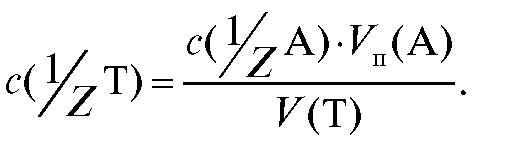
39. Расчет массы и процентного содержания определяемого вещества по результатам титрования.
Расчет с использованием молярной концентрации эквивалента титранта
Аликвотную долю раствора определяемого вещества 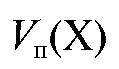 титруют
титруют
раствором титранта объемом V(T). В этом случае для реакции, протекающей в растворе в процессе титрования:
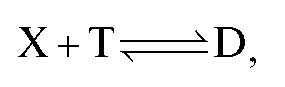
закон эквивалентов имеет вид: 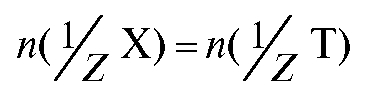 и
и
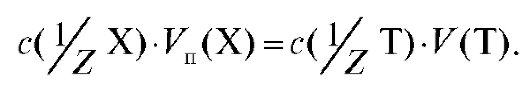 (2.13)
(2.13)
Отсюда молярная концентрация эквивалента определяемого вещества, рассчитанная по результатам титрования, равна:
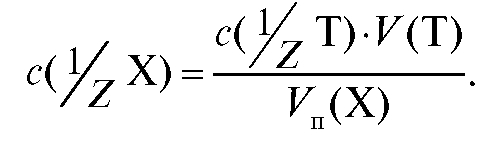 (2.14)
(2.14)
Полученное выражение подставляют в уравнение (2.2) и получают формулу для расчета массы определяемого вещества в колбе объемом 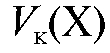 по результатам прямого титрования:
по результатам прямого титрования:
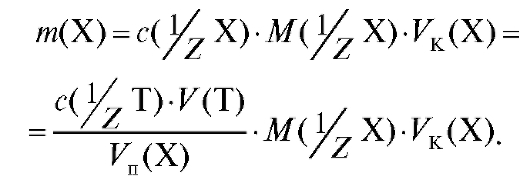 (2.15)
(2.15)
Если при титровании часть титранта расходуется на реакцию с индикатором, проводят «холостой опыт» и определяют объем титранта V' (Т),
израсходованный на титрование индикатора. При расчетах этот объем вычитают из объема титранта, который пошел на титрование раствора определяемого вещества. Такая поправка вносится при проведении «холостого опыта» во все расчетные формулы, применяемые в титриметрическом анализе. Например, формула (2.15) для расчета массы определяемого вещества с учетом «холостого опыта» будет иметь вид:
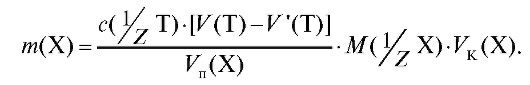 (2.16)
(2.16)
Расчет с использованием титриметрического фактора пересчета
Имеем анализируемый раствор объемом 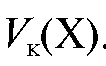 На титрование алик-
На титрование алик-
вотной доли 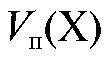 раствора определяемого вещества израсходован объем титранта V (Т) с теоретическим титриметрическим фактором пересчета
раствора определяемого вещества израсходован объем титранта V (Т) с теоретическим титриметрическим фактором пересчета 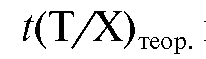 и поправочным коэффициентом F. Тогда масса определяемого вещества в аликвотной доле равна:
и поправочным коэффициентом F. Тогда масса определяемого вещества в аликвотной доле равна:
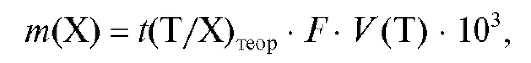 (2.17)
(2.17)
а во всем анализируемом объеме 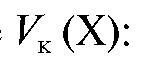
40. Определение содержания лекарственного вещества в препаратах.
Количественное определение лекарственного вещества может быть также выполнено с использованием спектров ЯМР. Относительная погрешность количественных определений методом ЯМР зависит от точности измерений площадей резонансных сигналов и составляет ±2—5%. При определении относительного содержания вещества или его примеси измеряют площади сигналов резонанса испытуемого вещества и стандартного образца. Затем вычисляют количество испытуемого вещества.
Для определения абсолютного содержания лекарственного вещества или примеси анализируемые образцы готовят количественно и добавляют к навеске точно отвешенную массу внутреннего стандарта. После этого выполняют регистрацию спектра, измеряют площади сигналов анализируемого вещества (примеси) и внутреннего стандарта, затем вычисляют абсолютное содержание.
ПМР-спектроскопия применена для испытания подлинности многих лекарственных веществ, в том числе барбитуратов, гормональных средств, антибиотиков и др.
Поскольку метод дает информацию о наличии или отсутствии примесей к основному веществу, важное практическое значение имеет ПМР-спектроскопия для испытания лекарственных веществ на чистоту. Различия в значениях величин тех или иных констант позволяют сделать заключение о присутствии примесей продуктов разложения лекарственного вещества. Чувствительность метода к примесям колеблется в широких пределах и зависит от спектра основного вещества, наличия в молекулах тех или иных групп, содержащих протоны, растворимости в соответствующих растворителях.
41.Способы выражения концентрации
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V: Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m
4. Титр – содержание вещества в граммах в 1 мл раствора
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества nк общему количеству веществ в растворе
6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Сущность метода кислотно-основного титрования Метод кислотно-основного титрования (метод нейтрализации) – предназначен для определения концентрации кислот, оснований, солей и основан на реакции нейтрализации. Реакции кислотно-основного взаимодействия являются реакциями передачи протона от титранта к определяемому веществу или наоборот; характеризуются высокой скоростью и протекают строго стехиометрически. Рабочими растворами метода являютсярастворы сильных кислот (HCl, H2SO4, HN03 и др.) или сильных оснований (NaOH, KOH, Ва(ОН)2 и др.). В зависимости от титранта метод кислотно-основного титрования подразделяют на ацидиметрию, если титрантом является раствор кислоты, и алкалиметрию, если титрантом является раствор основания.Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количество стандартного раствора реагента (титранта) становится теоретически строго эквивалентным количеству определяемого вещества согласно определенному уравнению химической реакции, называют точкой эквивалентности.Точку эквивалентности устанавливают различными способами, например по изменению окраски индикатора, прибавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования.
43. Типы кислотно-основного титрования: ацидиметрия, алкалиметрия (титранты, реакции).
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией. При количественном определении кислот (алкалиметрия) — рабочим раствором является раствор щелочи NaOH или КОН, при количественном определении щелочи (ацидиметрия) рабочим раствором является раствор сильной кислоты (обычно НСl или H2SO4)
Титрование сильной кислоты сильной щелочью: 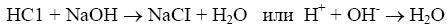
Точка эквивалентности находится в нейтральной среде (рН=7), т.к. образующаяся соль не подвергается гидролизу.
Титрование слабого основания сильной кислотой:
NH4OH + HCl = NH4Cl + H2O
Образующаяся соль слабого основания и сильной кислоты (NH4Cl) подвергается гидролизу, и в растворе накапливаются ионы Н+, что вызывает смещение точки эквивалентности в кислую среду. Следовательно, и в третьем случае точка эквивалентности не совпадает с точкой нейтральности.
44. Индикаторы, порядок и техника титрования. Расчеты при кислотно-основном титровании
Индикаторы кислотно-основного титрования представляют собой слабые органические кислоты и основания, у которых молекулярная и ионная формы отличаются окраской. В процессе диссоциации эти две формы находятся в равновесии. Изменение рН в кислотно-основном титровании нарушает равновесие процесса диссоциации индикатора, что вызывает накопление в растворе одной из форм индикатора, окраску которой можно визуально наблюдать. Для каждого индикатора есть свой интервал значений рН, в пределах которого индикатор изменяет свою окраску. Этот интервал называется областью перехода окраски индикатора. Окраске индикатора, при которой заканчивают титрование, отвечает определенное значение рН, лежащее внутри области перехода, которое называют показателем титрования этого индикатора. Для правильного выбора индикатора в различных случаях титрования необходимо знать предел скачка рН на кривой титрования. Для каждого случая титрования пригодны только те индикаторы, показатели титрования которых входят в пределы скачка рН на кривой.
Расчет кривой титрования начинается с вычисления pH исходного титруемого раствора. После точки эквивалентности pH раствора будет определяться количеством добавленного рабочего раствора. По данным построим кривую титрования: Точку пересечения кривой титрования с линией эквивалентности, называют точкой эквивалентности, а пересечение кривой титрования с линией нейтральности – точкой нейтральности. Резкое изменение pH в области точки эквивалентности называют скачком титрования. Расчеты показывают, что величина скачка титрования зависит от концентрации реагирующих веществ. Чем ниже концентрация реагентов, тем меньше скачок титрования. Повышение температуры также уменьшает скачок титрования.
45. Сущность метода окислительно-васстановительного титрования. Классификация редокс-методов. Требования к реакциям, условия проведения ОВ титрования
Методы окислительно-восстановительного титрования, или редокс-методы, основаны на использовании реакций с переносом электронов - окислительно-восстановительных реакций.
Окислительно-восстановительное титрование, или редоксиметрия, - это титрование, сопровождаемое переходом одного или большего числа электронов от иона-донора или молекулы (восстановителя) к акцептору (окислителю). Чем выше окислительно-восстановительный потенциал редокс пары Ox2|Red2, , тем большее число восстановителей Red1 можно оттитровать и определить с помощью данного окислителя Ox2. Поэтому в редоксиметрии в качестве титрантов чаще всего применяют окислители, стандартные окислително-восстановительные потенциалы редокс-пар которых имеют как можно более высокие значения, например (при комнатной температуре):
Классификация редокс-методов по характеру титранта·Оксидиметрия и Редуктометрия Классификация по природе реагента, взаимодействующего с определяемым веществом:Броматометрия ,Дихроматометрия,Иодатометрия,Бромометрия,Иодиметрия,Нитритометрия,Перманганатометрия,Хлориодиметрия,Цериметрия
Реакции, применяемые в методах окислительно-восстановительного титрования, должны отвечать следующим требованиям:
1)Реакции должны практически протекать до конца.
2)Реакция должна протекать достаточно быстро
3)Реакция должна протекать стехиометрически,
4)Конечная точка титрования должна определяться точно и однозначно либо с индикаторами, либо без индикаторов.
46 Виды окислительно-восстановительного титрования (прямое, обратное, заместительное).Расчетырезультатов
Прямое ОВ титрование проводят тогда, когда ОВ реакция удовлетворяет требованиям, перечисленным выше.
Зная объемы аликвоты анализируемого раствора и титранта, а также концентрацию раствора титранта ,рассчитывают концентрацию определяемого вещества в исходном анализируемом растворе.
Обратное ОВ титрование проводят тогда, когда применение прямого титрования нецелесообразно по тем или иным причинам.
Расчеты проводят, исходя из закона эквивалентов с учетом полуреакций
Заместительное ОВ титрование применяют для определения веществ как вступающих, так и не вступающих в ОВ реакции.
Расчеты проводят так же, как и при прямом титровании, исходя из закона эквивалентов.
47. Сущность перманганатометрии. Условия проведения титрования, титрант, его приготовление, стандартизация, хранение, определение конечной точки титрования. Применение метода в фармации.
Сущность метода. Перманганат калия — сильный окислитель, обладающий интенсивной фиолетово-малиновой окраской. В зависимости от кислотности титруемого раствора окислительные свойства перманганат-иона проявляются по-разному.
При проведении перманганатометрического титрования необходимо соблюдать, по крайней мере, следующие основные условия:
1) Влияние рН ср
2) Влияние температуры.
3) Фиксация конечной точки титрования
4) Ход титрования.
Титрантом метода является водный раствор перманганата калия, чаще всего — с молярной концентрацией эквивалента 0,1 моль/л.
Для получения титранта вначале готовят раствор перманганата калия с приблизительной концентрацией.После этого раствор стандартизуют.Стандартизацию раствора перманганата калия проводят по различным установочным веществам: H2C2O4• 2H2O, Na2C2O4, Аs2О3, KJ, (NH4)2Fe(SO4)2 • 6H2O, по металлическому железу и т.д. Часто стандартизацию проводят по стандартному раствору щавелевой кислоты.
Стандартизованный раствор перманганата калия хранят в темной склянке в темном месте.
конечная точка титрования- появление устойчивой розовой окраски титруемого раствора, исчезающей в течение одной-двух минут.
Перманганатометрия- один из лучших способ для определения наличия железа и различных окислителей и восстановителей в препаратах.
48. Химические реакции лежащие в основе йодометрического метода. Приготовление и условия хранения рабочих растворов йода и тиосульфата натрия, дихромата калия.
В основе йодометрического метода лежит полуреакция: I2 + 2 e  2 I – Из этого уравнения следует, что каждый атом иода присоединяет 1 электрон, и, следовательно, эквивалентная масса иода равна его атомной массе. Сначала к раствору окислителя (сульфата Fe3+) добавляют избыток йодида калия (восстановитель):
2 I – Из этого уравнения следует, что каждый атом иода присоединяет 1 электрон, и, следовательно, эквивалентная масса иода равна его атомной массе. Сначала к раствору окислителя (сульфата Fe3+) добавляют избыток йодида калия (восстановитель):
2I- + 2Fe3+ = I2 + 2Fe2+
А затем, титруют выделившийся йод тиосульфатом натрия:
Na2S2O3 + J2  2 NaJ + Na2S4O6-
2 NaJ + Na2S4O6-
Титрованный раствор йода можно приготовить исходя из точной навески химически чистого кристаллического йода, который очищают от примесей путем возгонки, этот раствор в процессе работы с ним и при длительном хранении меняет свой титр вследствие летучести йода, и периодически его нужно проверять.
Раствор тиосульфата готовят, растворяя навеску соли в свежепрокипяченой воде (для удаления СO2). Хранить готовый раствор Na2S2O3 рекомендуется в темных бутылях, защищенных от двуокиси углерода трубкой с натронной известью.
Раствор дихромата калия приготовляют растворением точной навески. Растворы дихромата калия чрезвычайно устойчивы при хранении в закрытых сосудах; он не разлагается даже при кипячении подкисленного раствора и практически не изменяется при стоянии раствора.
49. Крахмал как индикатор в йодометрии, приготовление. Использование метода йодометрии в анализе лекарственных веществ.
При титровании разбавленного и неокрашенного раствора в качестве индикатора используют соединения йода с крахмалом. Окрашивается раствор в интенсивно синий цвет. Чувствительность реакции очень высокая и позволяет фиксировать концентрации йода на порядок меньше чем по собственной окраске йода, с повышением температуры чувствительность реакции уменьшается .
Раствор крахмала разрушается при хранении в течении нескольких дней под действием бактерий.
Хлороформ и йодид ртути подавляет действие бактерий. Скорость разложения крахмала снижается и раствор хранится дольше.
К анализируемому раствору содержащий йод ,крахмал добавляют в конце титрования, когда раствор приобретает слабую соломенно-желтую окраску ,так как большая концентрация йода разрушает крахмал.
Интенсивно синюю окраску так же дают многие соединения состоящие коллоидного раствора ,фиксируют конечную точку титрования в методе йодометрии с помощью комплексно-абсорбционного раствора крахмала и йода.
50. Йодометрия в фармации.
Йодометрия - метод окислительно-восстановительного титрования, основанный на реакциях, связанных с окислением восстановителей свободным йодом I2 или с восстановлением окислителей йодидом калия KI. Оба процесса можно выразить следующей схемой
Т.к. стандартный окислительно-восстановительный потенциал пары невелик йод является относительно слабым окислителем, а ионы I – сравнительно сильным восстановителем.
С помощью метода йодометрии можно определять:
1. Восстановители
а) путем прямого титрования анализируемого раствора раствором йода
б) путем обратного титрования, Используется, если скорость взаимодействия восстановителя с йодом невелика. В этом случае к раствору восстановителя добавляют избыток титрованного раствора I2, а спустя некоторое время не вступивший в реакцию йод титруют раствором тиосульфата натрия
2. Окислители
Проводить определение, титруя раствор окислителя йодидом калия KI нельзя, т.к. невозможно фиксировать конец титрования. Поэтому пользуются методом замещения: к анализируемому раствору окислителя добавляют избыток раствора KI
В результате реакции выделяется йод в количестве, эквивалентном количеству окислителя; йод титруют раствором тиосульфата натрия.
Титрованный раствор йода можно приготовить исходя из точной навески химически чистого кристаллического йода, который очищают от примесей путем возгонки.
Однако, очистка йода представляет собой очень трудоемкую операцию. Кроме того, титрованный раствор в процессе работы с ним и при длительном хранении меняет свой титр вследствие летучести йода, и периодически его нужно проверять. Поэтому обычно готовят раствор I2 приблизительно нужной концентрации (0,05–0,1 н.) растворением навески йода в растворе KI (40 г/л). Точную концентрацию полученного раствора устанавливают по раствору тиосульфата натрия (реакция 2.10).
Тиосульфат натрия Na2S2O3•5Н2О является неустойчивым веществом. Оно легко реагирует с углекислым газом и кислородом воздуха.
51. Рабочий раствор, стандартный раствор и химические реакции лежащие в методе нитратометрии. Способы фиксации точки эквивалентности.
Нитритометрия
Нитритометрия — метод количественного анализа ароматических аминов, основанный на их титровании нитритом натрия.
Теория
Метод основан на реакции первичных аминов с азотистой кислотой с образованием диазосоединений:

Титрантом является раствор нитрита натрия. Катализатором служит раствор бромида калия, облегчающий процесс диазотирования. Точка эквивалентности определяется при помощи индикаторов — тропеолина 00 (переход от красного цвета раствора к жёлтому), нейтрального красного (переход от красно-фиолетового цвета к синему), иодкрахмальная бумага, а также потенциометрически (с платиновым электродом в качестве индикаторного электрода, хлорсеребряного или каломельного в качестве электрода сравнения). Титрование проводят при пониженной температуре, чтобы избежать разложения азотистой кислоты и соли диазония.
Практика
Для титрования обычно используют 0,1М раствор нитрита натрия. Навеску препарата (например, лекарственного средства класса сульфаниламидов) растворяют в 10 мл воды, прибавляют 10 мл 8,3%-го раствора соляной кислоты, 1 г KBr. Титрование ведут при температуре 15-20°С или 0-5°С до изменения цвета индикатора. Одновременно проводится контрольный опыт.
Нитритометрия используется для количественного анализа соединений с первичной или вторичной ароматической аминогруппой, гидразидов и ароматических нитросоединений после восстановления их нитрогруппы до аминогруппы.
52. Рабочий раствор, стандартный раствор и химические реакции лежащие в методе броматометрии. Способы фиксации точки эквивалентности.
Броматометрия — метод окислительно-восстановительного титрования, основанный на реакции восстановления бромат-иона.
При появлении в растворе бромид-ионов в присутствии бромат-иона и катионов водорода начинается реакция:
В нейтральных растворах данная реакция не идёт. Выделяющийся элементный бром способен стехиометрически реагировать с органическими веществами без образования побочных продуктов.
В связи с этим броматометрия используется в двух типах анализа:
Прямая реакция бромат-иона с восстановителем
Реакция брома, образовавшегося при взаимодействии бромид- и бромат-ионов
Индикаторами в броматометрии служат азокрасители, например, метиловый оранжевый или метиловый красный,необратимо окисляющиеся бромат-ионами с образованием бесцветных продуктов. Также могут быть использованы некоторые индикаторы, способные обратимо изменять свой цвет, в частности, хинолиновый жёлтый, α-нафтофлавон, п-этоксихризоидин. Конец титрования определяют также по появлению бурой окраски выделяющегося брома, а также потенциометрическим или фотометрическим способом.
Рабочим раствором в броматометрии является бромат калия, растворы которого готовят из точной навески. Эти растворы достаточно стабильны при хранении. При необходимости концентрацию бромат-ионов определяют иодометрическим титрованием. Иногда готовят нейтральные растворы с точно известной концентрацией KBrO3 и примерно пятикратно большей концентрацией KBr.
Броматометрическим титрованием определяют неорганические ионы, например, Sn(II), Cu(I), Tl(I), гидразин, пероксид водорода, а также Sb(III) и As(III):
Реакцию ведут в присутствии индикатора, исчезновение окраски которого свидетельствует об окончании титрования.
Броматометрическим титрованием определяют также органические вещества, например, фенол, крезол, анилин, резорцин, салициловую кислоту, ненасыщенные соединения. Например, фенолы определяют по реакции бромирования
Избыток бромат-иона определяют иодометрическим способом.
Прямым броматометрическим титрованием определяют тиомочевину, органические сульфиды, щавелевую кислоту.
Косвенным методом определяют содержание в растворах ионов Al, Mg, Mn(II), Ca, Ni, Co, Cu(II), Cd, Fe(III), La(III). Для этого эти ионы осаждают 8-гидроксихинолином в виде малорастворимых соединений, отделяют, растворяют в кислоте и оттитровывают образовавшийся 8-гидроксихинолин.
Дата добавления: 2016-06-24; просмотров: 5412;
