Основные положения теории электролитической диссоциации С.Аррениуса.
1.При растворении молекулы неорганических и некоторых органических соединений диссоциируют на ионы.
HCl 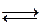 H+ + Cl- (4a)
H+ + Cl- (4a)
NaOH 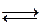 Na+ + OH- (4б)
Na+ + OH- (4б)
K2SO4 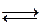 2K+ + SO4-2 (4в)
2K+ + SO4-2 (4в)
CH3COOH 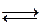 H+ + CH3COO - (4г)
H+ + CH3COO - (4г)
Это постулировалось, причины диссоциации не рассматривалась, не обсуждался также вопрос почему заряженные частицы не взаимодействуют друг с другом.
2.Диссоциация молекул на ионы не является полной, вводилась степень диссоциации a.
0<a<1
Соответственно доля неразложившихся частиц была 1 - a. Если ввести 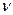 - стехиометрический коэффициент, т.е. коэффициент показывающий количество частиц, на которое диссоциирует данная молекула, то для реакции 4а, 4б, 4г
- стехиометрический коэффициент, т.е. коэффициент показывающий количество частиц, на которое диссоциирует данная молекула, то для реакции 4а, 4б, 4г 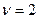 ,а для реакции 4в
,а для реакции 4в 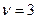 .Тогда можно записать:
.Тогда можно записать:
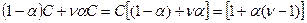
Это означает, что:
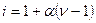 (4.4)
(4.4)
Поскольку 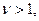
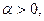 i > 1. Таким образом удалось количественно рассчитать величину изотонического коэффициента. Коэффициент a получил название кажущейся степени диссоциации.
i > 1. Таким образом удалось количественно рассчитать величину изотонического коэффициента. Коэффициент a получил название кажущейся степени диссоциации.
3. К процессу электролитической диссоциации как к любой химической реакции применим закон действующих масс. Предположим, протекает химическая реакция
А + В = С (4.д)
В состоянии равновесия не может быть произвольных соотношений между концентрациями веществ А, В и С, они определяются следующим выражением:
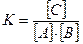 , (4.5)
, (4.5)
где квадратные скобки означают концентрацию соответствующего компонента, а К – константа равновесия.
В общем случае для реакции
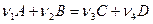
 (4.е)
(4.е)
константа будет равна:
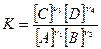 (4.6)
(4.6)
Запишем реакцию диссоциации какого-либо вещества:
МА 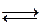 М+ + А- (4.ж)
М+ + А- (4.ж)
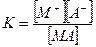 (4.7)
(4.7)
Выразим концентрацию [МА] с учетом степени диссоциации: концентрацию недиссоциировавших частиц можно записать как
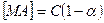 , (4.8)
, (4.8)
тогда концентрация распавшихся
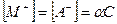 . (4.9)
. (4.9)
Подставив (4.8) и (4.9) в (4.7), получим:
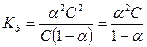 (4.10)
(4.10)
В частном случае для малодиссоциирующих электролитов ( 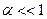 ), получаем, что
), получаем, что
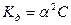 (4.11)
(4.11)
 (4.12)
(4.12)
Уравнения (4.10), (4.12) носят название законов разведения В.Оствальда. (В. Оствальд – российский (латвийский) физик, впоследствии лауреат Нобелевской премии).
Теория электролитической диссоциации нашла хорошее экспериментальное подтверждение, и за ее разработку в 1903г. С. Аррениус был удостоен Нобелевской премии. Между тем, у теории С. Аррениуса были свои недостатки:
1. неясен механизм диссоциации молекул на ионы;
2. непонятно отсутствие взаимодействий между заряженными частицами.
С критикой теории С.Аррениуса выступал известный русский ученный Д.И. Менделеев.
Дата добавления: 2017-01-29; просмотров: 1148;
