Ион - дипольное взаимодействие. Механизмы образования растворов.
Наиболее распространенным в природе растворителем является вода. Она обладает высокой диэлектрической проницаемостью, ε = 83. Диэлектрическая проницаемость - это отношение напряженности электрического поля в вакууме к напряженности поля в однородной изотропной среде при неизменных зарядах, создающих поле. Она показывает, во сколько раз уменьшается сила взаимодействия электрических зарядов при переносе их из вакуума в однородную изотропную среду, если расстояние между зарядами остается неизменным.
Например для эфираε= 4,3,что существенно ниже, чем в случае воды, т.е. при переносе заряда из вакуума в среду (воду), сила взаимодействия уменьшается в 83 раза, а из вакуума в эфир лишь – в 4,3 раза.
Именно высокая диэлектрическая проницаемость воды является причиной разложения на ионы. При диссоциации происходит химическая реакция взаимодействия иона с молекулой растворителя (воды). Этот процесс называется сольватацией (гидратацией). Если при растворении в воде или другом растворителе энергия гидратации (сольватации) окажется равной или близкой к энергии связей кристаллической решетки, то в этом случае произойдет разрушение кристаллической решетки вещества и начнется процесс растворения и образования гидратированных (сольватированных) ионов.
Схематически это можно выразить следующим образом:

Рис. 4.2 Гидратация иона меди.
С другой стороны, например, в случае с хлористым водородом происходит его взаимодействие с молекулой воды с образованием соляной кислоты и дальнейшей диссоциацией на ионы:
HCl + H2O 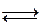 H3O+ + Cl- (4.з)
H3O+ + Cl- (4.з)
Таким образом, возможны два механизма образования растворов с одновременной диссоциацией на ионы:
1. если ионы существуют в кристаллической решетке, тогда при растворении в воде (растворителе) гидратная (сольватная) оболочка, стабилизирует существование ионов в растворе (рис. 4.2);
2. если в веществе, находящемся в газообразном, жидком или твердом состоянии ионы отсутствуют, гидратация обеспечивает их диссоциацию и последующую стабилизацию ионов (реакция 4.з).
Подобный механизм образования ионов позволяет утверждать, что они образуются не под действием электрического тока, а уже при растворении. Рассмотренный механизм объясняет их устойчивость в растворах электролитов (см. рис. 4.2).
Теория С.Аррениуса вместе с теорией гидратации (сольватации), разработанной Д.И. Менделеевым, достаточно хорошо описывала поведение растворов электролитов, но только для разбавленных растворов. Как следует из всего вышеизложенного, она основана на ион - дипольном взаимодействии. Именно ион - дипольное взаимодействие объясняет механизм образования растворов и их устойчивость. Учет ион - дипольного взаимодействия позволил существенно развить теорию С.Аррениуса, однако для концентрированных растворов электролитов это оказалось недостаточным.
Для описании их поведения было введено понятие об активности ионов. Активность - это кажущаяся (эффективная) концентрация ионов, которая меньше их концентрации, определенной в растворе
ai = fi Ci, (4.13)
где C i – концентрация иона, ai – его активность; fi – коэффициент активности (безразмерная величина) fi < 1.
Активность зависит от общей ионной силы раствора:
 (4.14)
(4.14)
где Ci – концентрация иона, а Zi – его заряд.
При постоянной ионной силе раствора коэффициенты активности равны. Был введен средний коэффициент активности:
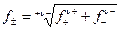 , (4.15)
, (4.15)
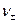 - число катионов и анионов, образующихся при диссоциации электролита.
- число катионов и анионов, образующихся при диссоциации электролита.
Введение коэффициента активности связано с необходимостью создания теории электролитов для концентрированных растворов.
Дата добавления: 2017-01-29; просмотров: 2653;
