Ионные равновесия при растворении. Произведение растворимости.
Ниже на основе теории электролитической диссоциации будет осуществлена количественная трактовка процессов растворения различных соединений. Запишем уравнение электролитичекой диссоциации малорастворимого соединения, например сульфата бария:
BaSO4(тв.) 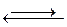
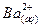 +
+ 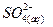 (5.k)
(5.k)
Тогда 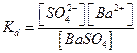 . Учитывая, что величина [BaSO4] практически постоянна, можно записать [BaSO4]×Kd =
. Учитывая, что величина [BaSO4] практически постоянна, можно записать [BaSO4]×Kd = 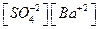 = ПР, т.е. произведение
= ПР, т.е. произведение 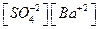 постоянно. Чем оно меньше, тем меньше растворимость соответствующего соединения.
постоянно. Чем оно меньше, тем меньше растворимость соответствующего соединения.
Эта константа носит название произведения растворимости (ПР)
ПР = 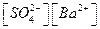 (5.18)
(5.18)
В общем случае можно записать, что для реакции:
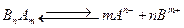 (5.л)
(5.л)
величина произведения растворимости может быть выражена соотношением:
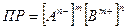 (5.19)
(5.19)
Если произведение 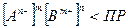 , то вещество будет находиться в растворе. Если же
, то вещество будет находиться в растворе. Если же 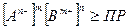 , то вещество будет выпадать в осадок до тех пор, пока не будет установлено равновесие (достигнуто произведение растворимости). Чем ниже произведение растворимости, тем труднее растворимо вещество.
, то вещество будет выпадать в осадок до тех пор, пока не будет установлено равновесие (достигнуто произведение растворимости). Чем ниже произведение растворимости, тем труднее растворимо вещество.
Значения произведения растворимости находятся в справочных таблицах.
Таблица. 5.2
Значения произведения растворимости для некоторых труднорастворимых соединений
| Уравнение диссоциации | ПР |
BaSO4  Ba2+ + Ba2+ + 
| 1×10-10 |
Ag2CrO4  2Ag+ + 2Ag+ + 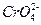
| 2×10-12 |
Ag2CO3  2Ag+ + 2Ag+ + 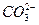
| 8×10-12 |
Al(OH)3  Al+3 +3OH- Al+3 +3OH-
| 1×10-34 |
Cd(OH)2  Cd2+ + 2OH- Cd2+ + 2OH-
| 3×10-14 |
Из значения произведения растворимости легко вычислить растворимость (S) соответствующего соединения 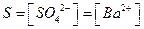 .
.
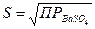 (5.20)
(5.20)
Запишем дляAg2CrO4 произведение растворимости  , тогда
, тогда 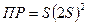 . Откуда получаем уравнение для растворимости Ag2CrO4:
. Откуда получаем уравнение для растворимости Ag2CrO4:
 (5.21)
(5.21)
Аналогичным образом можно рассчитать произведение растворимости для Al(OH)3
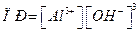
ПР = S(3S)3 = 27S4
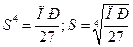 (5.22)
(5.22)
Таким образом можно из значения произведения растворимости рассчитать растворимость любого соединения.
Вопросы и задачи
- pH раствора сильной кислоты равно 4,4. Определить концентрацию ионов водорода.
- Вычислить pH 0,01М раствора гидроксида серебра.
- Вычислить pH 0,01М раствора азотной кислоты.
- Определить pH 0,1М раствора натриевой соли синильной кислоты.
- Вычислить pH 0,1М раствора метаборнокислого натрия (формула метаборной кислоты HBO2).
- Вычислить pH 0,1М раствора синильной кислоты.
- Вычислить концентрацию ионов водорода и гидроксила раствора сильной кислоты, если его pH равно 0,3.
- Вычислить концентрацию ионов водорода и гидроксила в 1×10-3М растворе KOH.
- Электроосаждение цинка проходит из водного раствора сульфата цинка при pH = 10. Что необходимо добавлять в раствор этой соли, чтобы достичь требуемого значения pH?
- При электрохимической обработке меди скорость обработки ограничивается растворимостью образующейся при этом соли. Раствор какой соли целесообразно использовать, чтобы достичь максимальной скорости обработки?
- Пользуясь табличными данными определить, какая соль в большей степени растворима в воде: AgCl или Ag2CrO4?
- Растворимость гидроксида цинка составляет 2,2×10-5 г в 100 г воды. Вычислить
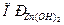 .
. - Произведение растворимости гидроксида кальция
 = 5,5×10-6. Вычислить pH раствора, содержащего 0,01 моль/л Ca(OH)2.
= 5,5×10-6. Вычислить pH раствора, содержащего 0,01 моль/л Ca(OH)2. - Рассчитать растворимость карбоната серебра (
 = 8,2×10-12).
= 8,2×10-12).
Дата добавления: 2017-01-29; просмотров: 1581;
