Общая характеристика растворов
Растворы имеют большое значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов.
Растворы – многокомпонентные гомогенные системы, в которых одно или несколько веществ распределены в виде молекул, атомов или ионов в среде другого вещества – растворителя.
Раствор может иметь любое агрегатное состояние – твердое, жидкое или газообразное. Всякий раствор состоит из растворенных веществ и растворителя. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (например, раствор соли в воде: соль – растворенное вещество, вода – растворитель). Если оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
По структуре растворы занимают промежуточное положение между механическими смесями и химическими соединениями. С механическими смесями их роднит переменность состава, а с химическими соединениями – однородность состава по всей фазе и наличие теплового эффекта при образовании. В соответствии с этим первое время существовали две противоборствующие теории: "физическая" и "химическая", каждая из которых отстаивала свои взгляды на строение растворов.
Современные представления о строении растворов основываются на сольватной теории, выдвинутой Менделеевым и развитой его последователями. Согласно этой теории, в системе при растворении одновременно происходит два процесса: диффузия растворяемого вещества в объеме растворителя (физический процесс) и образования из молекул растворителя и растворяемого вещества нестойких соединений переменного состава – сольватов (химический процесс). Если растворителем служит вода, то эти соединения называют гидратами.
Образование растворов является процессом самопроизвольным, идущим с увеличением беспорядка системы, т.е. с повышением энтропии. Например, при растворении кристалла система из полностью упорядоченного состояния переходит в менее упорядоченное. При этом с увеличением энтропии (AS > 0) уменьшается свободная энергия системы (AG <0).
Если раствор образуется из 2 жидкостей, то движущая сила процесса растворения обусловлена стремлением компонентов раствора к выравниванию концентраций, что также приводит к увеличению энтропии, т.е. AS > 0, a AQ < 0. Растворение вещества – процесс обратимый. И как всякий обратный процесс, растворение заканчивается установлением динамического равновесия: нерастворенное вещество – вещество в растворе. Раствор, находящийся в равновесии с растворяющимся веществом, называют насыщенным раствором, а достигнутую предельную концентрацию насыщенного раствора – растворимостью.
Важнейшей характеристикой раствора является его состав или концентрация компонентов.
Концентрация растворов– количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя.
Концентрацию растворов можно выражать по-разному. В химической практике наиболее употребительны следующие способы выражения концентраций:
1. Массовая доля растворенного вещества (процентная концентрация)– показывает, сколько граммов вещества растворено в 100 г раствора. Она определяется по формуле:
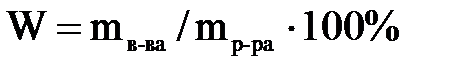 , (4.1)
, (4.1)
где W – массовая доля растворенного вещества,
m в-ва – масса растворенного вещества,
m р-ра – масса раствора.
2. Молярная концентрация– показывает, сколько молей растворенного вещества содержится в 1 л раствора.
3. Моляльная концентрация– показывает, сколько молей вещества содержится в 1 кг растворителя.
Дата добавления: 2017-01-29; просмотров: 1293;
