Свойства растворов электролитов
Электролиты– вещества, растворы или расплавы, которые проводят электрический ток.
Электролитами являются кислоты, основания и соли. По сравнению с металлами, проявляющими электронную проводимость и являющимися проводниками первого рода, электролиты относят к проводникам второго рода.
Электрическая проводимость растворов и расплавов электролитов обусловлена наличием в них положительно и отрицательно заряженных ионов, которые образуются из молекул или кристаллических веществ в результате распада их при растворении в воде или плавлении.
Электролитическая диссоциация– распад электролита на ионы в водных растворах или расплавах.
Причиной, вызывающей распад растворенного вещества на ионы, является интенсивное взаимодействие ионов с молекулами растворителя, т.е. сольватация ионов. Частный случай сольватации ионов есть гидратация, т.е. взаимодействие их с водой.
Впервые представление о гидратации ионов было введено Д.И. Менделеевым в его химической теории растворов. Дальнейшие исследования И.А. Каблукова и В.А. Кистяковского, а также теория электролитической диссоциации С. Аррениуса позволили объяснить свойства растворов электролитов.
Основные положения теории электролитической диссоциации для водных растворов:
1. При растворении в воде молекулы электролитов диссоциируют (распадаются) на положительно и отрицательно заряженные ионы. Ионы могут быть образованы из одного атома – простые ионы и нескольких атомов – сложные ионы.
2. Диссоциация – обратимый процесс. Как правило, он не протекает до конца, а в системе устанавливается динамическое равновесие, т.е. такое состояние, при котором скорость диссоциации равна скорости обратного процесса образования исходных молекул.
Количественная характеристика равновесного состояния диссоциации слабого электролита может быть получена также с использованием степени диссоциации б, которая показывает, какая часть молекул электролита в растворе распалась на ионы:
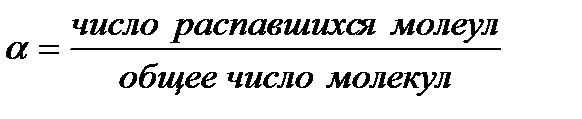 .
.
Значение б всегда меньше единицы. Умножая б на 100, получают долю ионизированных молекул в процентах.
Степень диссоциации б связана с константой диссоциации (К) соотношением:
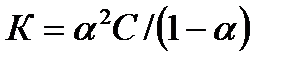 , (4.6)
, (4.6)
где С – концентрация электролита в растворе.
Степень диссоциации электролита зависит от разбавления. Если растворитель удаляется из раствора, концентрация электролита увеличивается, ионы при этом снова соединяются, образуя недиссоциированные молекулы. Наоборот, при разбавлении степень диссоциации возрастает. При бесконечном разбавлении раствора (т. е. при концентрации близкой к нулю) электролиты полностью распадаются на ионы
3. Ионы в водном растворе находятся в хаотическом движении. Если в раствор электролита опустить электроды и приложить к ним электрическое напряжение, то ионы приобретают направленное движение: положительные ионы перемещаются к катоду (отрицательному электроду), а отрицательные ионы – к аноду (положительному электроду). Вследствие этого ионы получили названия: положительные – катионы, отрицательные – анионы.
Вопросы для самоконтроля:
1. Что называется раствором?
2. Охарактеризуйте способы выражения концентраций.
3. Как объяснить понижение растворимости газов с повышением температуры?
4. На чем основана экстракция вещества из раствора?
5. Чем можно объяснить, что растворение некоторых твердых веществ сопровождается выделением теплоты?
6. Какой может быть тепловой эффект при растворении жидкости в жидкости?
7. В 250 мл раствора KCl содержится 30 г растворенного вещества. Вычислите молярную и нормальную концентрацию этого раствора.
Дата добавления: 2017-01-29; просмотров: 1524;
