Химическое равновесие
Обратимые реакциимогут идти в двух взаимопротивоположных направлениях. Они не доходят до конца, а заканчиваются установлением химического равновесия.
Химическое равновесие–состояние системы, когда скорости прямой и обратной реакции становятся равными.
Состояние химического равновесия сохраняется до тех пор, пока не изменятся условия. При изменении внешних условий равновесие нарушается, и через некоторое время система придет в новое состояние равновесия.
Сдвиг равновесия–переход системы из одного состояния равновесия в другое.
Направление смещения равновесия определяется принципом Ле Шателье.
Если на равновесную систему оказано воздействие, то равновесие смещается в сторону, ослабляющую данное воздействие.
Например, увеличение температуры смещает равновесие в сторону эндотермической реакции, увеличение концентрации исходных веществ смещает равновесие с сторону продуктов реакции. Давление изменяет равновесие только реакций, в которых участвуют газы. Увеличение давления смещает равновесие в сторону реакции, идущей с изменением объема.
Вопросы для самоконтроля:
1. Что изучает кинетика?
2. Что называется скоростью химических реакций?
3. Почему в математическом уравнении скорости химической реакции стоит знак "минус"?
4. Перечислите факторы, влияющие на скорость химической реакции.
5. Опишите влияние концентрации, температуры, природы реагирующих веществ на скорость химической реакции.
6. Что называется катализом и катализатором?
7. Как классифицируют каталитические реакции?
8. Что такое ингибиторы?
9. Что называется химическим равновесием?
10. Что называется сдвигом химического равновесия?
11. Сформулируйте принцип Ле Шателье.
12. В какую сторону сместится равновесие равновесной реакции при увеличении температуры? Давления (если в реакциях принимают участие газы)? Концентрации одного из реагирующих веществ?
РАЗДЕЛ 2.КОЛЛОИДНАЯ ХИМИЯ
Тема 2.1. Поверхностные явления. Адсорбция
Адсорбция, ее виды
Разнообразные явления, возникающие на границах раздела веществ различных агрегатных состояний, происходят вследствие особого энергетического состояния пограничных поверхностей. Любая поверхность вне зависимости от агрегатного состояния разделяемых ею веществ располагает некоторым запасом свободной энергии. Как и любая система, обладающая запасом свободной энергии, поверхность раздела веществ стремится к самопроизвольному уменьшению этой энергии и служит прямо или косвенно причиной многочисленных физических явлений, в том числе адсорбции.
Адсорбция – это самопроизвольное повышение концентрации вещества у поверхности раздела двух фаз в гетерогенной системе, сопровождающееся уменьшением свободной межфазной энергии.
Абсорбция– процесс сорбции, при котором поглощаемое вещество диффундирует в глубь поглотителя и распределяется по объему.
Поглощение, сопровождающееся химическим взаимодействием поглощаемого вещества с веществом-поглотителем, носит название хемосорбции.
То вещество, на поверхности которого идет адсорбция, принято называть адсорбентом, а вещество, которое адсорбируется, – адсорбатом.
Адсорбцию А обычно выражают соотношением адсорбата X, приходящимся на единицу площади поверхности адсорбента S, в кмоль/м2:
A = X/S (5.1)
Если адсорбентом является твердое пористое тело, общую поверхность которого определить невозможно, то адсорбцию А относят к единице массы адсорбента в кмоль/кг:
А = Х/m (5.2)
Силы взаимодействия адсорбента и адсорбата, определяющие адсорбцию, различны, и обычно рассматривают два крайних случая, когда адсорбция характеризуется физическими либо химическими взаимодействиями. Физическая адсорбция протекает самопроизвольно, и этот процесс является динамическим: наряду с адсорбцией идет обратный процесс – десорбция, которая характеризуется удалением адсорбционных молекул с поверхности адсорбента. Скорость адсорбции с течением времени уменьшается, а скорость десорбции с течением времени увеличивается. Эти изменения происходят до тех пор, пока их скорости не становятся одинаковыми, т. е. наступает адсорбционное равновесие.
Для каждой температуры существует свое состояние равновесия.
Так как химическая адсорбция обусловлена образованием связей, близких к химическим, десорбция протекает с большим трудом.
Адсорбция носит избирательный характер. Так, например, активированный уголь хорошо поглощает хлор, но не адсорбирует угарный газ (СО). Поэтому нельзя пользоваться обычными противогазами при тушении пожаров, так как в зоне пожара много СО.
2.1.2 Адсорбция на границе раздела "раствор-газ"
Растворенные вещества в зависимости от их природы могут адсорбироваться (концентрироваться) на поверхности раствора или переходить в объем раствора, что приводит к изменению поверхностного натяжения жидкости.
Возможны три варианта влияния растворенного вещества на поверхностное натяжение растворителя:
1) растворенное вещество понижает поверхностное натяжение (d<d0);
2) растворенное вещество повышает поверхностное натяжение (d>d0);
3) растворенное вещество не изменяет поверхностного натяжения растворителя (d=d0).
Вещества, которые уменьшают поверхностное натяжение растворителя, называются поверхностно-активными(ПАВ). Вещества, увеличивающие поверхностное натяжение или его не изменяющие, называются поверхностно-инактивными (ПИВ).Это деление условно, так как однии те же вещества по отношению к одним растворителям являются ПАВ, по отношению к другим – ПИВ. Например, ацетат натрия по отношению к воде – ПАВ, а по отношению к этилацетату – ПИВ.
ПИВ относительно воды являются многие органические соединения – жирные кислоты, их соли, спирты, амины. Характерной особенностью строения молекул ПАВявляется их дифильность.
Величина адсорбции А на границе раствор – газ определяется как количество адсорбированного вещества в поверхностном слое по сравнению с количеством вещества в таком же по толщине слое объемной фазы. Между избытком адсорбированного вещества в поверхностном слое и концентрацией его в растворе (С) существует математическая зависимость, установленная Гиббсом и известная как уравнение адсорбции Гиббса:
А = – C / RT × dd / dC (5.3)
Отношение dd / dC называется поверхностной активностью. Для ПАВ dd / dC < 0, поэтому А > 0, для ПИВ dd / dC > 0 и А < 0, т.е. адсорбция отрицательная. Если поверхностное натяжение не изменяется при изменении концентрации растворенного вещества, то dd / dC = 0 и А = 0.
Поверхностная активность ПАВ зависит от размера углеводородного радикала.
Правило Траубе.Увеличение длины цепи молекул ПАВ в данном гомологическом ряду на одну группу СН2 вызывает возрастание поверхностной активности в 3-3,5 раза.
Расположение молекул ПАВ в поверхностных слоях зависит от их концентрации в этих слоях.
При низких концентрациях ПАВ в растворе и соответственно в адсорбционном слое полярная группа дифильной молекулы погружена в воду, а углеводородный радикал лежит на поверхности воды. При увеличении концентрации раствора молекулы ПАВ сначала соединяются в агрегаты, в которых радикалы ориентируются параллельно друг другу, а затем вся поверхность жидкости покрывается мономолекулярным слоем вертикально ориентированных молекул. При дальнейшем увеличении концентрации ПАВ в растворе строение адсорбционного слоя и поверхностное натяжение не меняются.
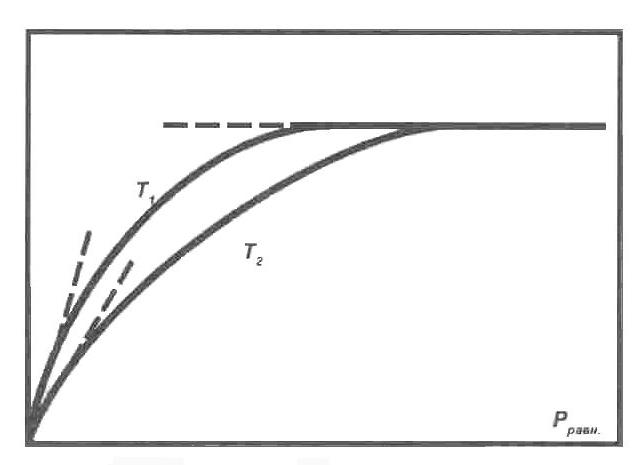
Рис. 5. Изотермы адсорбции
Адсорбция газа на твердом адсорбенте идет самопроизвольно. Одновременно с адсорбцией идет десорбция. При равенстве скоростей этих двух процессов наступает динамическое равновесие. При равновесии концентрация газа в окружающей среде (давление) и концентрация газа на поверхности адсорбента постоянны. С увеличением давления до определенного предела возрастает адсорбция. На адсорбционное равновесие оказывает влияние температура. Увеличение температуры приводит к уменьшению адсорбции. Графическая зависимость адсорбции от давления при постоянной температуре называется изотермой адсорбции.
На рисунке 5 показаны две изотермы адсорбции, отвечающие температурам Т 1, и Т 2, причем Т 2 < Т 1участка. В области малых давлений (участок 1) изотерма прямолинейна, т.е. адсорбция возрастает пропорционально равновесному давлению.
При дальнейшем повышении давления (участок 2) количество адсорбированных веществ увеличивается, но в меньшей степени. При больших давлениях изотерма имеет вид прямой (участок 3), т.е. с увеличением давления адсорбция не изменяется. Это предел адсорбции, отвечающий полному насыщению поверхности адсорбента молекулами адсорбата. По форме изотерма адсорбции напоминает параболу, и поэтому для ее аналитического выражения Фрейндлихом было предложено эмпирическое уравнение Фрейндлиха:
X / m = к р 1/n, (5.4)
где X – количество адсорбированного газа,
m – масса адсорбента,
р – равновесное давление газа,
К и 1/n – постоянные.
Уравнение Фрейндлиха применимо для интервала давлений, в котором изотерма имеет вид кривой (участок 2). Оно не применимо для описания адсорбции при очень малых и больших давлениях, когда изотерма адсорбции прямолинейна.
Изотермы адсорбции растворенных веществ из растворов аналогичны адсорбционным изотермам для газов и для разбавленных растворов, хорошо подчиняются уравнениям Фрейндлйха и Ленгмюра, если в них поставить равновесную концентрацию (С) растворенного вещества в растворе. Однако адсорбция из растворов более сложное явление по сравнению с газовой адсорбцией, потому что наряду с адсорбцией растворенного вещества на поверхности адсорбента может происходить адсорбция растворителя. В результате этого между адсорбентом и растворителем происходит конкуренция за "обладание адсорбентом" и чем хуже адсорбируется растворитель, тем лучше адсорбируется растворенное вещество. Поэтому часто обычная изотерма адсорбции искажается. Все адсорбенты можно разбить на два основных типа: гидрофильные, хорошо смачивающиеся водой, и гидрофобные, которые смачиваются органическими жидкостями. К гидрофильным относятся: силикагель, глины, пористые стекла, осадочные горные породы – диатомит (кизельгур), трепел. Эти адсорбенты целесообразно использовать для адсорбции из неводных растворов, например, для очистки сиропов, масел, нефтепродуктов, при очистке жиров от свободных жирных кислот, смолистых и красящих веществ. Гидрофобные адсорбенты – активированный уголь, графит, тальк – хорошо адсорбируют вещества из водных растворов. Их используют в спиртовом производстве для удаления сивушных масел. В сахарной и крахмалопаточной промышленности углем обесцвечивают сахарные и глюкозные сиропы.
Адсорбция вещества из раствора идет медленнее адсорбции газа, так как уменьшение концентрации в граничном слое может восполняться только путем диффузии растворенного вещества в поры адсорбента, что осуществляется довольно медленно. Для ускорения установления адсорбционного равновесия часто применяют перемешивающиеся системы. На адсорбцию влияет также способность растворителя растворять адсорбтив: чем лучше растворяется адсорбтив, тем хуже идет адсорбция из раствора. С повышением температуры адсорбция обычно уменьшается, однако не так сильно, как адсорбция газов, но иногда, когда температурный коэффициент растворимости вещества отрицательный, адсорбция увеличивается.
Адсорбция зависит и от строения молекул адсорбтива. Дифильные молекулы растворенного вещества при адсорбции на твердом адсорбенте ориентируются на его поверхности так, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная – к неполярной.
Сильные электролиты в водных растворах практически полностью диссоциированы на ионы, и, как правило, на твердом адсорбенте из раствора адсорбируются преимущественно ионы одного вида.
Преимущественная адсорбция из раствора или катиона или аниона зависит от природы ионов – их заряда, радиуса и степени гидратации. Чем больше заряд иона, тем лучше он адсорбируется. Из ионов с одинаковым зарядом лучше адсорбируется ион, имеющий наибольший радиус, так как он имеет наименьшую степень гидратации. Гидратная оболочка препятствует адсорбции, поэтому, чем меньше степень гидратации, тем ион лучше адсорбируется.
Правило Фаянса-Панетта.На поверхности кристаллического твердого тела из раствора адсорбируется тот из ионов, который входит в состав кристаллической решетки или может образовывать с одним из ионов решетки малорастворимое соединение.
Дата добавления: 2017-01-29; просмотров: 1237;
