Свойства коллоидных растворов
По своим оптическим свойствам коллоидные растворы отличаются от истинных и грубодисперсных систем.
В грубодисперсных системах размер частиц больше длины волны видимого света. Поэтому световые лучи, проходящие через грубодисперсную систему, не могут обойти частицы суспензии или эмульсии, они отражаются и преломляются на границе частиц со средой, обусловливая их мутность, видимую невооруженным глазом.
В истинных растворах светорассеяние ничтожно, так как размер частиц дисперсной фазы очень мал и нет препятствий для прохождения лучей.
Наиболее характерным оптическим свойством коллоидных растворов является опалесценция (светорассеяние). Частицы коллоидной дисперсности меньше длины полуволны света, и поэтому рассеяние света обусловлено не отражением света от поверхности частиц, а его дифракцией. Рассеяние света было исследовано Тиндалем, который обнаружил, что при освещении коллоидного раствора световым пучком его путь при наблюдении сбоку виден в виде светящегося конуса – конуса Тиндаля. Подобное явление наблюдается при прохождении луча в темном задымленном помещении (например, во время показа кино), при свете автомобильных фар в туманную погоду и в других случаях.
Для интенсивности рассеянного света Релеем в 1871 году была выведена зависимость:
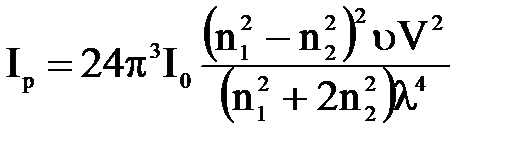 , (2.2)
, (2.2)
где Ip – интенсивность рассеянного света,
I0 – интенсивность падающего света,
n1 и n2 – показатели преломления дисперсионной фазы и дисперсионной среды,
u – концентрация,
V – объем одной частицы,
l – длина световой волны.
Из этого уравнения видно, что интенсивность рассеянного света обратно пропорциональна 4-й степени длины волны. Если падающий свет полихроматичен, то рассеянный свет должен быть богаче короткими волнами, т. е. при боковом освещении коллоиды имеют синеватую окраску, а в проходящем красную.
На интенсивности рассеяния лучей коротковолновой части спектра основано применение ламп синего цвета для светомаскировки и красного для сигналов опасности. Красный свет виден на большое расстояние из-за малого светорассеяния. По той же причине противотуманные фары имеют оранжевую окраску.
Броуновское движение дисперсных (раздробленных) частиц обусловлено беспрерывными их соударениями с молекулами дисперсионной среды, находящимися в постоянном тепловом движении. Результирующая сила этих толчков хаотическипередвигает дисперсную частицу в различных направлениях и ее сложный путь охватывает определенный объем пространства. Этот ломаный путь неопределенной конфигурации (в плоскости горизонтальной проекции на произвольно выбранную ось) может быть, тем не менее, охарактеризован средним сдвигом частицы АХ за время t (сек). Он представляет собой отрезок прямой, соединяющий начальную точку движения (t-0) с положением частицы в момент времени t.
Процесс самопроизвольного выравнивания концентраций дисперсных частиц по всему объему раствора, происходящий под влиянием Броуновского движения, называется диффузией. Скорость этого процесса характеризуется коэффициентом диффузии. Выравнивание концентраций в растворе прямо связано с различием значений химических потенциалов в разбавленных участках раствора и в участках с более высокой концентрацией.
Осмос – избирательная диффузия молекул дисперсионной среды (только растворителя) через полупроницаемую мембрану. Осмотическое давление – это давление, которое необходимо приложить к раствору по ту сторону мембраны, куда движутся молекулы растворителя, чтобы предотвратить перенос растворителя, то есть осмос. Явление осмоса применимо как к молекулярным, так и к коллоидным растворам. Величина осмотического давления определяется только частичной концентрацией (концентрацией коллоидных частиц) и не зависит от их природы и размера. Для разбавленного коллоидного раствора осмотическое давление рассчитывается по уравнению, аналогичному уравнению Вант-Гоффа.
В 1809 году профессор Московского университета Ф.Ф. Рейс описал неизвестные ранее явления, положившие начало изучению электрических свойств дисперсных систем.
Если в слой сырой глины погрузить на близком расстоянии две стеклянные трубки с водой, в которые насыпан песок, исполняющий роль пористого тела, погрузить инертные электроды и создать разность потенциалов, то уровень жидкости в трубке с положительным электродом понизится, а жидкость помутнеет. В трубке с отрицательным электродом жидкость не мутнеет и уровень ее повысится. Таким образом, при наличии разности потенциалов дисперсная фаза и дисперсионная среда двигаются в противоположных направлениях.
Электрофорез– перемещение частиц дисперсной фазы в электрическом поле.
Электроосмос– перемещение дисперсионной среды в электрическом поле.
Электрофорез используют при обезвоживании нефти, при очистке газообразных отходов производства (электрофильтры), при изготовлении гуммированных покрытий и резиновых изделий из латекса, в медицине для введения в организм лекарств в коллоидном состоянии. Электроосмос используется при опреснении воды, при очистке лекарств, дублении кожи.
В коллоидных системах различают два вида устойчивости – агрегативную и седиментационную.
Дисперсная система считается седиментационно-устойчивой, если ее дисперсные частицы не оседают, т.е. находятся в стабильном седиментационном равновесии. Если размеры частиц дисперсной фазы постоянны, то коллоидная система бесконечно долго может сохранять седиментационную устойчивость. Но частицы дисперсной фазы склонны укрупняться путем их слияния или перекристаллизации. Укрупнение частиц в дисперсной системе приводит к нарушению седиментационной устойчивости и выпадению осадка.
Агрегативная устойчивость– способность дисперсной системы сохранять неизменными размеры частиц дисперсной фазы.
Процесс слипания коллоидных частиц, образование более крупных агрегатов с последующей потерей коллоидной системой седиментационной устойчивости называется коагуляцией.
Коагуляцию можно вызвать нагреванием, замораживанием, центрифугированием, добавлением различных электролитов. Все эти воздействия, различные по своей природе, или уменьшают силы притяжения между коллоидными частицами, или увеличивают силы притяжения между ними. Так, при нагревании возрастает кинетическая энергия коллоидных частиц, увеличивается их скорость движения и силы отталкивания уже не могут препятствовать агрегированию мицелл.
Прибавление электролитов приводит к снижению электрокинетического потенциала и уменьшению сил отталкивания.
В заключение отметим, что явление, обратное коагуляции, т.е. разрушение агрегатов частиц под действием чистой дисперсионной среды или растворенных веществ, называется пептизацией.
Вопросы для самоконтроля:
1. Какими методами получают коллоидные системы?
2. Какими методами коллоидные растворы очищают от примесей электролитов?
3. Каково строение мицеллы, и какие ее части движутся к электродам при электрофорезе?
4. Что такое коагуляция, и какие факторы ее вызывают?
5. Какой ион электролита обладает коагулирующим действием, и как коагулирующая способность связана с зарядом ионов?
6. Как изменяются поверхностные и электрокинетические потенциалы при концентрационной и нейтрализационной коагуляции?
7. Какое состояние золя называется изоэлектрическим?
8. Каково практическое значение коагуляции?
Дата добавления: 2017-01-29; просмотров: 1141;
