Скорость химической реакции
Кинетика –учение о скорости и механизме химических реакций.
Вопрос о скорости химической реакции имеет большое практическое и теоретическое значение. От скорости реакции зависит течение биохимических процессов в организме, физико-химические изменения пищевых продуктов при тепловой обработке, производительность заводской аппаратуры.
Скорость химических процессов можно регулировать, изменяя условия их протекания. В некоторых случаях желательно интенсифицировать процесс, чтобы получить больше продукта в единицу времени. Иногда требуется уменьшить скорость химической реакции, например, замедлить окисление жиров в пищевых продуктах. Все эти задачи можно решить, применяя законы химической кинетики.
Скорость реакции–изменение концентрации реагирующих веществ в единицу времени.
u = -Dс/Dt, (3.1)
где Dс – изменение концентрации реагирующих веществ,
Dt – промежуток времени.
Зависимость скоростных химических реакций от концентрации определяетсязаконом действующих масс, открытым опытным путем К.М. Гульдбергом и П. Вааге в 1867 году.
Для реакции аА + bB = С
u = 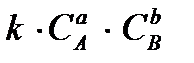
 (3.2)
(3.2)
где: А и B – концентрации реагирующих веществ,
а и b – коэффициенты в уравнении,
k – коэффициент пропорциональности, называемый константой скорости, зависящей от природы реагирующих веществ и температуры.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных коэффициентам в уравнении реакции.
Константа скорости реакциичисленно равна скорости реакции при концентрациях реагирующих веществ, равных единице.
Факторы, влияющие на скорость химической реакции:
· природа реагирующих веществ;
· концентрация реагирующих веществ;
· температура;
· давление (для газов);
· площадь соприкосновения реагирующих веществ;
· присутствие катализатора.
При повышении температуры увеличивается скорость движения молекул, а, следовательно, и число столкновений между ними в единицу времени.
Влияние температуры на скорость химической реакции подчиняется правилу Вант-Гоффа.
При повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза.
Число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры на 10 градусов, называется температурным коэффициентом реакции. Математически эта зависимость выражается соотношением:
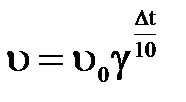 , (3.3)
, (3.3)
где g – температурный коэффициент реакции,
u и u0 – скорости реакции при начальной (t1) и конечной (t2) температурах;
Dt – изменение температуры t2 – t1.
Правило Вант-Гоффа приближенное и может применяться к реакциям, протекающим при температурах от 0 до 300 градусов и в небольшом температурном интервале. С повышением температуры температурный коэффициент скорости реакции уменьшается, приближаясь к единице.
Более точная зависимость скорости химической реакции от температуры экспериментально установлена Аррениусом:
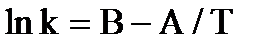 , (3.4)
, (3.4)
где k – константа скорости реакции,
В и А – постоянные для данной реакции.
Дата добавления: 2017-01-29; просмотров: 835;
