Реакция выделения водорода (водородный электрод).
Таблица 14.1.
Токи обмена для разряда ионов H+ на различных электродах в водных растворах HCl или H2SO4
| Электрод | 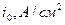
| Электрод | 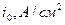
|
| Hg InZn Bi Ga (ж) | 7×10-13 8×10-12 5×10-11 1×10-10 3×10-10 | Ag Cu Au Fe Pt | 1×10-8
1,5×10-7
3×10-7
3×10-6
 0,1 0,1
|
Реакция катодного выделения водорода является многостадийной и механизм её протекания различный на различных электродах. Для нее могут наблюдаться следующие механизмы:
А. электрохимическая десорбция (реакция Я.Гейровского) наблюдается на ртути, индии, таллии, висмуте, кадмии и др.
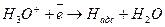 (14.а)
(14.а)
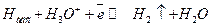 (14.б)
(14.б)
В щелочных растворах реакция (14.б) может протекать с участием молекул воды.
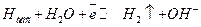 (14.в)
(14.в)
Как следует из механизма (14.а) и (14.в) медленной является электрохимическая стадия получения адсорбированного водорода, стадии (14.б) и (14.в) равновесные. Как видно из данных сопоставления с плотностями тока обмена, механизм А приводит в основном к существенной необратимости реакции выделения водорода (низкие плотности тока обмена).
Б. (вольфрам, молибден, ниобий, тантал).
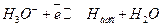 (14.г)
(14.г)
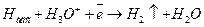 (14.д)
(14.д)
то есть замедленной является последующая электрохимическая стадия.
В. удаление адсорбированного водорода может происходить путём рекомбинации при медленной стадии разряда.
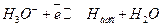 (14.е)
(14.е)
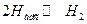 (14.ж)
(14.ж)
Г. замедленной является гетерогенная химическая стадия рекомбинации адсорбированного водорода (анодно активированные металлы платиновой группы).
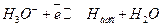 (14.з)
(14.з)
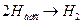 (14.и)
(14.и)
Дата добавления: 2017-01-29; просмотров: 1027;
