Коррозия при кислородной деполяризации.
Наиболее широко распространённой является коррозия в присутствии растворённого кислорода. Реакция восстановления кислорода имеет вид:
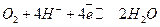 (15.з)
(15.з)
Величина концентрации растворённого кислорода в воде 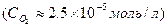 . Поскольку эта концентрация очень низка, на поляризационной кривой для реакции (15.з) всегда будет наблюдаться предельный диффузионный ток восстановления кислорода.
. Поскольку эта концентрация очень низка, на поляризационной кривой для реакции (15.з) всегда будет наблюдаться предельный диффузионный ток восстановления кислорода.
Рассмотрим коррозионную диаграмму для этого случая. Кривая катодного восстановления кислорода имеет несколько областей (рис. 15.3):
область А– зависимость скорости реакции восстановления растворенного кислорода от потенциала;
область В – предельный диффузионный ток восстановления кислорода (зависящий от скорости перемешивания (потока электролита));
область С – наблюдается при более высоких катодных потенциалах и соответствует реакции восстановления 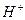 до газообразного водорода.
до газообразного водорода.
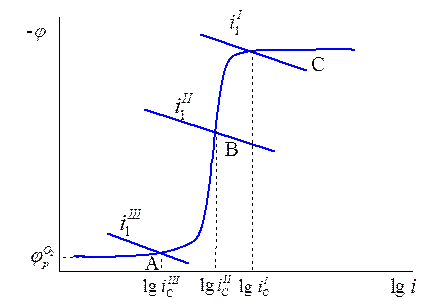
Рис. 15.3 Коррозионные диаграммы для коррозии с кислородной деполяризацией.
Можно себе представить, что для различных металлов будут реализовываться различные поляризационные кривые (зависимости скорости анодного растворения от потенциала 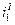 ,
, 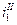 ,
, 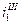 ). Равенство скоростей для металла I даст ток коррозии
). Равенство скоростей для металла I даст ток коррозии 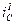 . Совершенно очевидно, что это будет коррозия с водородной деполяризацией, поскольку область С – это область восстановления водорода. Несомненно, что коррозия для металлов II и III будет происходить с кислородной деполяризацией и подчиняться различным закономерностям. Коррозия для металла II будет существенно зависеть от скорости перемешивания, поскольку область В– это предельный диффузионный ток восстановления кислорода, зависящий от скорости перемешивания.
. Совершенно очевидно, что это будет коррозия с водородной деполяризацией, поскольку область С – это область восстановления водорода. Несомненно, что коррозия для металлов II и III будет происходить с кислородной деполяризацией и подчиняться различным закономерностям. Коррозия для металла II будет существенно зависеть от скорости перемешивания, поскольку область В– это предельный диффузионный ток восстановления кислорода, зависящий от скорости перемешивания.
Плотность тока коррозии для металла III будет:
- меньше плотности тока коррозии с кислородной деполяризацией в области предельного диффузионного тока;
- она не будет зависеть от скорости перемешивания.
Коррозия для металла II и III называется коррозией с кислородной деполяризацией, поскольку катодным процессом восстановления является восстановление растворенного кислорода (15.з). Общее условие коррозии можно выразить следующим образом:
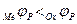 , (15.3)
, (15.3)
где 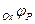 - равновесный потенциал восстановления окислителя, а
- равновесный потенциал восстановления окислителя, а 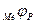 - равновесный потенциал металла.
- равновесный потенциал металла.
Кинетическая теория коррозии позволяет не только объяснить достигаемую скорость коррозии, но и управлять ею, что показано выше в случае с кислородной деполяризацией.
Дата добавления: 2017-01-29; просмотров: 1091;
