Кинетическая теория коррозии.
Рассмотрим схематически семейство поляризационных кривых, включающих растворение металла и восстановление окислителя (рис. 15.1).

Рис. 15.1 Схема образования потенциала саморастворения.
Пусть кривая 1 - это поляризационная кривая для системы металл - ионы металла; 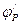 -это равновесный потенциал для этой реакции. Кривая 2 – это поляризационная кривая для реакции разряда - ионизации водорода:
-это равновесный потенциал для этой реакции. Кривая 2 – это поляризационная кривая для реакции разряда - ионизации водорода:
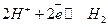
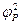 -это равновесный потенциал для этой реакции.
-это равновесный потенциал для этой реакции.
Очевидно, что обязательно должен существовать некий потенциал 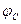 , при котором по абсолютной величине плотность катодного тока будет равна плотности анодного тока:
, при котором по абсолютной величине плотность катодного тока будет равна плотности анодного тока:
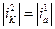 (15.1)
(15.1)
т.е. катодный ток (плотность тока) восстановления водорода будет равен анодному току (плотности тока) растворения металла.
Потенциал, при котором достигается условие (15.1) носит название стационарного потенциала. Величины 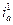 и
и 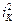 можно рассматривать как плотности тока обмена. Существенная разница заключается в том, что плотность тока обмена является скоростью процессов одной реакции, протекающей в разных направлениях, т.е. в катодном направлении и в анодном направлении, а в данном случае рассматриваемая плотность тока является плотностью тока двух различных реакций окисления и восстановления.
можно рассматривать как плотности тока обмена. Существенная разница заключается в том, что плотность тока обмена является скоростью процессов одной реакции, протекающей в разных направлениях, т.е. в катодном направлении и в анодном направлении, а в данном случае рассматриваемая плотность тока является плотностью тока двух различных реакций окисления и восстановления.
Если в качестве реакции 1 использовать, например, реакцию растворения цинка, а в качестве реакции 2 - реакцию выделения водорода, тогда суммируя реакции (15.д) и (15.е) получим (15.ж), которая представляет собой реакцию растворения цинка в кислоте с выделением водорода.
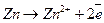 (15.д)
(15.д)
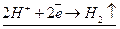 (15.е)
(15.е)
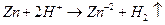 (15.ж)
(15.ж)
Реакция (15.ж) является химической, а реакции (15.д) и (15.е) - электрохимические. Таким образом, видно, что химическая реакция саморастворения цинка в кислоте является суммой сопряжённых реакций растворения металла (15.д) (протекает в прямом направлении) и восстановления (15.е) (в обратном направлении). В общем случае число сопряжённых процессов может быть очень большим и при стационарном потенциале:
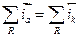 , (15.2)
, (15.2)
то есть сумма скоростей всех анодных реакций равна сумме скоростей всех катодных реакций. Между стационарным потенциалом и равновесным имеется существенная разница.
- Равновесный потенциал отвечает равенству скоростей окисления и восстановления одного и того же вещества (например: железа, цинка, меди и т.д.), а стационарный потенциал равенству суммарных скоростей катодных и анодных реакций различных систем.
- При равновесном потенциале состав фаз постоянен, при стационарном потенциале химический состав изменяется, поэтому стационарный потенциал может изменяться во времени, т.е., по существу, стационарным не является, более правильное его название – потенциал обесточенного электрода.
- Равновесный потенциал не зависит от состояния поверхности и является табличной величиной. Стационарный потенциал зависит от многих факторов, в том числе и от состояния поверхности, поэтому он очень трудно воспроизводится.
Другое название 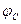 - потенциал коррозии, а
- потенциал коррозии, а 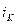 - ток (плотность тока) коррозии. Как уже указывалось, коррозия - процесс взаимодействия металла с элементами окружающей среды. Согласно кинетической теории коррозии скорость коррозии определяется плотностью тока анодного растворения металла в реакции, сопряжённой реакции катодного восстановления окислителя.
- ток (плотность тока) коррозии. Как уже указывалось, коррозия - процесс взаимодействия металла с элементами окружающей среды. Согласно кинетической теории коррозии скорость коррозии определяется плотностью тока анодного растворения металла в реакции, сопряжённой реакции катодного восстановления окислителя.
Определить скорость коррозии можно по коррозионной диаграмме, на которой представлены поляризационные кривые растворения метала и восстановления окислителя.

Рис. 15.2 Коррозионная диаграмма.
Рассмотрим коррозионную диаграмму, включающую растворение металла и выделение газообразного водорода (рис. 15.2). Совершенно очевидно, что в точке, которую обозначим 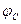 , будет достигнуто равенство скоростей анодного растворения металла и восстановления окислителя (в данном случае водорода). Таким образом, приравняв эти две скорости друг к другу, а также зная зависимость плотности тока анодного растворения металла и зависимость плотности тока катодного восстановления окислителя от потенциала, можно определить скорость коррозии. Она определяет скорость растворения металла. Кинетическая теория коррозии, в основе которой лежит постулат (доказанный экспериментально) о том, что коррозия представляет собой сопряжённый процесс электрохимического растворения металла и катодного восстановления окислителя, позволяет рассчитывать скорость и потенциал коррозии, и следовательно, управлять этими процессами.
, будет достигнуто равенство скоростей анодного растворения металла и восстановления окислителя (в данном случае водорода). Таким образом, приравняв эти две скорости друг к другу, а также зная зависимость плотности тока анодного растворения металла и зависимость плотности тока катодного восстановления окислителя от потенциала, можно определить скорость коррозии. Она определяет скорость растворения металла. Кинетическая теория коррозии, в основе которой лежит постулат (доказанный экспериментально) о том, что коррозия представляет собой сопряжённый процесс электрохимического растворения металла и катодного восстановления окислителя, позволяет рассчитывать скорость и потенциал коррозии, и следовательно, управлять этими процессами.
Дата добавления: 2017-01-29; просмотров: 855;
