ПОНЯТИЕ О ХИМИЧЕСКОМ ПОТЕНЦИАЛЕ
Выражения I закона термодинамики справедливы при условии неизменности количества составляющих систему веществ, которое определяется числом моль  .
.
Продифференцируем уравнение (27)
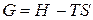 (27)
(27)
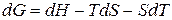 ,
,
выразим из (з) 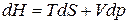 .
.
Решая совместно последние выражения для 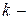 компонентной системы, с учетом изменения числа моль компонентов, участвующих в физико-химическом процессе, получим уравнение для изменения энергии Гиббса системы:
компонентной системы, с учетом изменения числа моль компонентов, участвующих в физико-химическом процессе, получим уравнение для изменения энергии Гиббса системы:
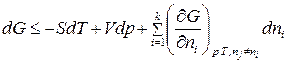 . (1)
. (1)
В (1) знак «<» относится к самопроизвольному процессу, а знак «=» – к равновесному. Частная производная от энергии Гиббса по изменению числа моль одного из компонентов при неизменности чисел моль остальных компонентов и соответствующих параметров состояния – это химический потенциал 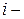 го компонента
го компонента 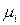 .
.
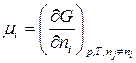 . (2)
. (2)
С учетом (2) получим:
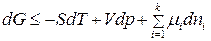 . (3)
. (3)
Химический потенциал можно выразить через частные производные и других термодинамических потенциалов
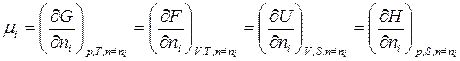 (4)
(4)
и аналогично уравнению (1) выразить энергию Гельмгольца 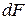 ,
, 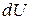 ,
, 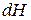 .
.
Химический потенциал размерная величина – 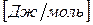 .
.
Химический потенциал имеет физический смысл парциальной мольной работы при изменении числа моль данного компонента на единицу при постоянных внешних параметрах и числах моль всех других компонентов, составляющих раствор.
Для изобарно-изотермических условий, когда 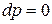 и
и 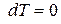 , из (3) при равновесии имеем:
, из (3) при равновесии имеем:
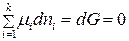 . (5)
. (5)
Для однокомпонентной системы из (5), получим:
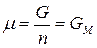 , (6)
, (6)
где 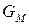 – мольная энергия Гиббса индивидуального вещества или мольный термодинамический потенциал.
– мольная энергия Гиббса индивидуального вещества или мольный термодинамический потенциал.
Таким образом, химический потенциал индивидуального вещества тождественен мольной энергии Гиббса.
Зависимость химического потенциала 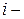 го компонента от состава газовой смеси выражается уравнениями:
го компонента от состава газовой смеси выражается уравнениями:
– для идеального газа 
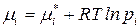 ;
;
– для реального раствора 
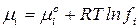 ,
,
где 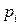 – парциальное давление
– парциальное давление 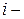 го компонента в газовой смеси;
го компонента в газовой смеси;
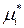 – стандартный химический потенциал индивидуального
– стандартный химический потенциал индивидуального 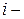 го компонента (
го компонента ( 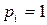 );
);
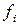 – парциальная фугитивность
– парциальная фугитивность 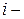 го компонента в газовой смеси;
го компонента в газовой смеси;
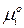 – стандартный химический потенциал
– стандартный химический потенциал 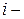 го компонента в газовой смеси (
го компонента в газовой смеси ( 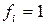 ).
).
Фугитивность (летучесть) – величина, которую нужно подставить в выражение для химического потенциала 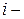 го компонента идеальной газовой смеси, чтобы получить значение химического потенциала этого компонента в реальной газовой смеси.
го компонента идеальной газовой смеси, чтобы получить значение химического потенциала этого компонента в реальной газовой смеси.
Фугитивность связана с парциальным давлением компонента уравнением

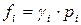 ,
,
где 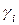 – коэффициент фугитивности
– коэффициент фугитивности 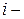 го компонента.
го компонента.
По аналогии зависимость химического потенциала 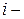 го компонента от состава жидкого раствора выражается уравнениями:
го компонента от состава жидкого раствора выражается уравнениями:
– для идеального раствора: 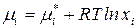 ;
;
– для реального раствора: 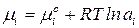 ,
,
где 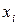 – мольная доля
– мольная доля 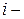 го компонента в растворе;
го компонента в растворе;
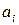 – активность
– активность 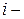 го компонента в растворе.
го компонента в растворе.
Активностью 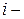 го компонента раствора называют величину, которую нужно подставить в выражение для химического потенциала компонента в идеальном растворе, чтобы получить действительное значение химического потенциала
го компонента раствора называют величину, которую нужно подставить в выражение для химического потенциала компонента в идеальном растворе, чтобы получить действительное значение химического потенциала 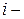 го компонента в реальном растворе.
го компонента в реальном растворе.
Активность связана с концентрацией компонента через коэффициент активности 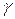 :
:
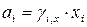 ;
;
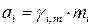 ;
;
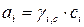 ,
,
где 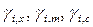 – рациональный, моляльный и молярный коэффициенты активности
– рациональный, моляльный и молярный коэффициенты активности 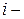 го компонента в растворе, соответственно;
го компонента в растворе, соответственно;
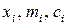 – мольная доля, моляльная и молярная концентрации
– мольная доля, моляльная и молярная концентрации 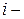 го компонента в растворе, соответственно.
го компонента в растворе, соответственно.
Между 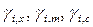 существует вполне определенная взаимосвязь.
существует вполне определенная взаимосвязь.
2.2. Закон действия масс. константа
Дата добавления: 2017-01-29; просмотров: 1378;
