Уравнение больцмана
Состояние системы можно описать либо указав значения температуры, давления, объема и других свойств – это будет характеристика макросостояния системы, либо, указав свойства каждой частицы вещества, то есть ее положение в пространстве, массу, скорость и направление движения – это будет характеристика микросостояния системы.
Если рассмотреть некоторое количество газа с заданными термодинамическими параметрами 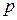 ,
,  и
и 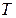 , то при постоянных внешних условиях макросостояние газа не изменяется, однако молекулы газа находятся в непрерывном хаотическом движении и данному макросостоянию будет отвечать большое число различных микросостояний, которое называется термодинамической вероятностью
, то при постоянных внешних условиях макросостояние газа не изменяется, однако молекулы газа находятся в непрерывном хаотическом движении и данному макросостоянию будет отвечать большое число различных микросостояний, которое называется термодинамической вероятностью 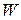 . Величина
. Величина 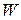 – есть мера вероятности данного макросостояния: чем больше
– есть мера вероятности данного макросостояния: чем больше 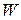 , тем вероятнее пребывание системы в данном состоянии.
, тем вероятнее пребывание системы в данном состоянии.
Процессы в изолированной системе направлены в сторону увеличения ее термодинамической вероятности. Равновесное состояние системы – это наиболее вероятное состояние. Как следует из II закона термодинамики, самопроизвольные процессы в изолированной системе характеризуются увеличением ее энтропии. Поэтому можно предположить, что энтропия и термодинамическая вероятность функционально связаны друг с другом. Связь между энтропией и термодинамической вероятностью выражается уравнением Больцмана:

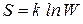 .
.
Уравнение Больцмана лежит в основе современной статистической термодинамики и позволяет понять свойства энтропии как функции состояния. При абсолютном нуле в системе абсолютный порядок ( 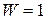 ) и энтропия
) и энтропия 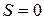 . При нагревании системы возникает тепловое движение, беспорядок в системе увеличивается и энтропия возрастает. Энтропия – мера беспорядка в системе.
. При нагревании системы возникает тепловое движение, беспорядок в системе увеличивается и энтропия возрастает. Энтропия – мера беспорядка в системе.
Дата добавления: 2017-01-29; просмотров: 878;
