Химического равновесия
Допустим, что в идеальной газовой фазе протекает химическая реакция:
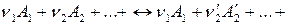 ,
,
где 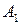 ,
, 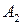 , … – исходные вещества:
, … – исходные вещества:
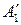 ,
, 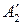 ,… – продукты реакции;
,… – продукты реакции;
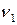 ,
, 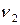 ,
, 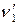 ,
, 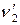 – стехиометрические коэффициенты.
– стехиометрические коэффициенты.
 Условием химического равновесия в системе является равенство
Условием химического равновесия в системе является равенство
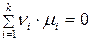 . (7)
. (7)
При химическом равновесии алгебраическая сумма произведений химических потенциалов компонентов на их стехиометрические коэффициенты равна нулю (произведения для продуктов реакции положительны, а для исходных веществ – отрицательны).
Подставив в условие равновесия выражение для химического потенциала: 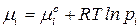 получим уравнение закона действующих масс: при равновесии отношение произведений парциальных давлений продуктов реакции, взятых в степенях их стехиометрических коэффициентов, к аналогичному отношению для исходных веществ, есть величина постоянная при постоянной температуре. Эта величина названа константой химического равновесия:
получим уравнение закона действующих масс: при равновесии отношение произведений парциальных давлений продуктов реакции, взятых в степенях их стехиометрических коэффициентов, к аналогичному отношению для исходных веществ, есть величина постоянная при постоянной температуре. Эта величина названа константой химического равновесия:

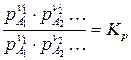 , (8)
, (8)
где 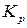 – константа химического равновесия.
– константа химического равновесия.
Константу химического равновесия можно выразить через молярности:


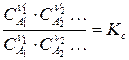
или мольные доли: 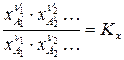

 Константа
Константа 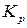 связана с
связана с 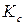 и
и 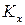 . Подставляя в (8) значения
. Подставляя в (8) значения 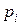 и
и 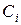 из уравнения Менделеева – Клапейрона
из уравнения Менделеева – Клапейрона 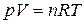 ,
, 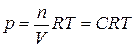 и Дальтона
и Дальтона 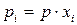 , получим :
, получим :
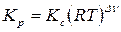 ;
; 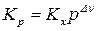 , (9)
, (9)
где 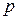 – общее давление в системе;
– общее давление в системе;
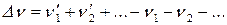 – изменение числа моль в ходе реакции.
– изменение числа моль в ходе реакции.
2.3. уравнение изотермы химической реакции
Направление самопроизвольного протекания химической реакции определяется убылью соответствующего термодинамического потенциала, а глубина протекания – абсолютной величиной этой убыли, т.е. максимальной полезной работой.
Для реакции, протекающей при 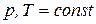 уравнение изотермы химической реакции записывается:
уравнение изотермы химической реакции записывается:

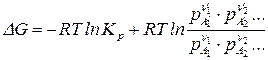 , (10)
, (10)
где 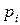 – исходные (неравновесные) парциальные давления реагирующих веществ.
– исходные (неравновесные) парциальные давления реагирующих веществ.
 Так как
Так как 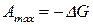 , то уравнение максимальной работы химической реакции запишется:
, то уравнение максимальной работы химической реакции запишется:
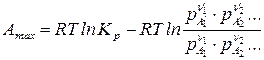 . (11)
. (11)
Аналогично для реакции, протекающей при 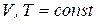 :
:

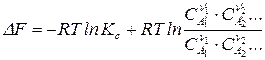 ;
;

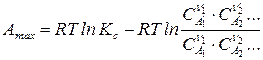 ,
,
где 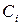 – исходные (неравновесные) концентрации реагирующих веществ.
– исходные (неравновесные) концентрации реагирующих веществ.
Абсолютные значения 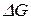 (
( 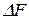 ) показывают, насколько далека система от состояния равновесия. Чем меньше
) показывают, насколько далека система от состояния равновесия. Чем меньше 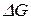 (
( 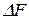 ), тем ближе система к состоянию равновесия. Если
), тем ближе система к состоянию равновесия. Если 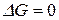 (
( 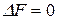 ), то система находится в состоянии равновесия. Поэтому величины
), то система находится в состоянии равновесия. Поэтому величины 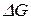 (
( 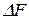 ) или
) или 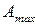 называют мерой химического сродства. На основе уравнения изотермы химической реакции можно предсказать направление самопроизвольного протекания химической реакции: если
называют мерой химического сродства. На основе уравнения изотермы химической реакции можно предсказать направление самопроизвольного протекания химической реакции: если 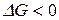 (
( 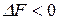 ), то процесс протекает самопроизвольно в сторону образования продуктов реакции, если
), то процесс протекает самопроизвольно в сторону образования продуктов реакции, если 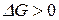 (
( 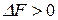 ), то процесс протекает в сторону образования исходных веществ.
), то процесс протекает в сторону образования исходных веществ.
Для приближенной оценки направления протекания химической реакции применяют стандартную энергию Гиббса или стандартное химическое сродство – энергию Гиббса при парциальных давлениях реагирующих веществ, равных единице 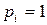 :
:

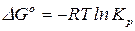 . (12)
. (12)
Аналогично для реакции, протекающей при 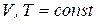 :
:

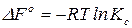 . (13)
. (13)
2.4. уравнения изобары и изохоры химической реакции.
Тепловая теорема нернста-Планка
Влияние температуры на константу химического равновесия характеризуется уравнениями изобары и изохоры химической реакции.
 Если реакция протекает при
Если реакция протекает при 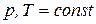 , то
, то
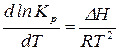 – уравнение изобары химической реакции. (14)
– уравнение изобары химической реакции. (14)
Если реакция протекает при 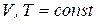 , то
, то

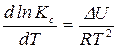 – уравнение изохоры химической реакции. (15)
– уравнение изохоры химической реакции. (15)
Уравнения изохоры и изобары позволяют прогнозировать изменение 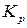 (
( 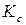 ) при изменении температуры. Знак производной (температурный коэффициент константы равновесия), стоящей в левой части уравнений, а, следовательно, и направление изменения константы равновесия при изменении
) при изменении температуры. Знак производной (температурный коэффициент константы равновесия), стоящей в левой части уравнений, а, следовательно, и направление изменения константы равновесия при изменении 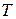 определяется знаком теплового эффекта химической реакции. Если реакция эндотермическая (
определяется знаком теплового эффекта химической реакции. Если реакция эндотермическая ( 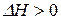 ), то с увеличением температуры
), то с увеличением температуры 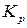 возрастает, если реакция экзотермическая (
возрастает, если реакция экзотермическая ( 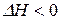 ), то
), то 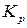 убывает.
убывает.
Основная задача химической термодинамики заключается в расчете константы химического равновесия и определении выхода продуктов реакции.
Разделим переменные в уравнении изобары (14)
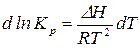 . (16)
. (16)
 Проинтегрируем уравнение в небольшом интервале температур, считая, что
Проинтегрируем уравнение в небольшом интервале температур, считая, что 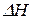 не зависит от температуры:
не зависит от температуры:
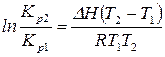 . (17)
. (17)
Уравнение (17) позволяет рассчитать тепловой эффект реакции, если известны значения констант равновесия в узком интервале температур.
Дата добавления: 2017-01-29; просмотров: 795;
