Порядок и молекулярность реакции
Основным законом химической кинетики является закон действующих масс:
Скорость химической реакции прямопропорциональна произведению концентраций молекул реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам в уравнении реакции.
Химические реакции, как правило, протекают по сложному механизму в несколько стадий, которые могут сильно различаться по своим скоростям. Самая медленная стадия химической реакции определяет скорость процесса и называется лимитирующей. Лимитирующая стадия может быть одна, а в некоторых случаях таких стадий может быть несколько, когда две или более стадий протекают с одинаковыми скоростями. Для элементарной реакция
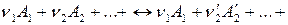 ,
,
отражающей протекание лимитирующей стадии процесса, то закон химической кинетики выражается уравнением

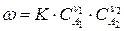 ,
,
где 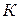 – константа скорости реакции.
– константа скорости реакции.
Сумма стехиометрических коэффициентов 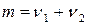 , выражающих число молекул, принимающих участие в единичном акте химического превращения, называется молекулярностью химической реакции. Молекулярность реакции может быть равна только целому числу: 1, 2 и реже 3.
, выражающих число молекул, принимающих участие в единичном акте химического превращения, называется молекулярностью химической реакции. Молекулярность реакции может быть равна только целому числу: 1, 2 и реже 3.
 Если механизм реакции недостаточно изучен, то закон химической кинетики имеет вид:
Если механизм реакции недостаточно изучен, то закон химической кинетики имеет вид:
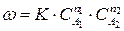 , (3)
, (3)
где 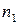 ,
, 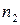 – эмпирические коэффициенты, которые называются частными порядками химической реакции.
– эмпирические коэффициенты, которые называются частными порядками химической реакции.
Сумма частных порядков 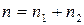 – называется порядком химической реакции. Частные порядки и общий порядок реакции определяются экспериментально и могут совпадать со стехиометрическими коэффициентами только для элементарных реакций, т.е. реакций, протекающих в одну стадию. Порядок реакции может принимать значения целые от 1 до 3-х, дробные и может быть равен нулю.
– называется порядком химической реакции. Частные порядки и общий порядок реакции определяются экспериментально и могут совпадать со стехиометрическими коэффициентами только для элементарных реакций, т.е. реакций, протекающих в одну стадию. Порядок реакции может принимать значения целые от 1 до 3-х, дробные и может быть равен нулю.
Константа скорости химической реакции имеет смысл удельной скорости химической реакции, т.е. скорости при концентрациях реагирующих веществ, равных 1. Константа скорости химической реакции не зависит от концентрации реагирующих веществ и времени, а определяется только природой этих веществ, характером химического превращения и температурой процесса.
4.2. кинетика необратимых реакций
Реакция нулевого порядка (n=0) 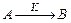 – это реакция, скорость которой не зависит от концентрации реагирующих веществ.
– это реакция, скорость которой не зависит от концентрации реагирующих веществ.
Реакции нулевого порядка протекают, если:
а) концентрация исходного вещества автоматически поддерживается постоянной (например, в насыщенном растворе, находящемся в равновесии с избытком нерастворенного вещества);
б) при протекании фотохимических и каталитических реакций, скорость которых определяет количество поглощенного света и количество катализатора.
 Закон химической кинетики для реакции нулевого порядка записывается:
Закон химической кинетики для реакции нулевого порядка записывается:
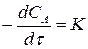 . (4)
. (4)
После интегрирования получаем:

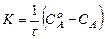 , (5)
, (5)
где 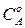 ,
, 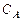 – начальная концентрация вещества
– начальная концентрация вещества 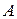 и в момент времени
и в момент времени 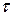 .
.
Время, в течение которого первоначальная концентрация исходного вещества снижается в два раза, называют временем полупревращения.
 Для реакции нулевого порядка
Для реакции нулевого порядка 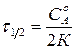 . (6)
. (6)
Реакция 1 порядка (n=1): 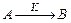 .
.
Основной закон химической кинетики

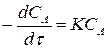 . (7)
. (7)
 Проинтегрировав, получим
Проинтегрировав, получим 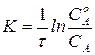 . (8)
. (8)
Для реакции первого порядка время полупревращения:

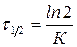 . (9)
. (9)
Реакция 2 порядка (n=2): 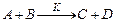 .
.
 Запишем основной закон химической кинетики
Запишем основной закон химической кинетики
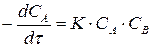 (10)
(10)
 Проинтегрируем
Проинтегрируем 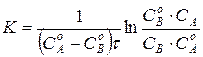 , (11)
, (11)
где 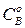 ,
, 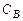 – начальная концентрация вещества
– начальная концентрация вещества 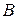 и в момент времени
и в момент времени 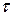 .
.
Для случая, когда 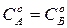 константу скорости реакции рассчитывают по уравнению:
константу скорости реакции рассчитывают по уравнению:

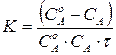 , (12)
, (12)
а время полупревращения:

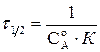 . (13)
. (13)
4.3. влияние температуры на скорость реакции
Температура оказывает большое влияние на скорость химической реакции. В соответствии с эмпирическим правилом Вант-Гоффа с увеличением температуры на каждые 10  скорость химической реакции увеличивается в 2 – 4 раза:
скорость химической реакции увеличивается в 2 – 4 раза:

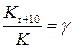 , (14)
, (14)
где 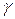 – температурный коэффициент скорости химической реакции.
– температурный коэффициент скорости химической реакции.
Расчет температурного коэффициента проводят по уравнению Вант-Гоффа:

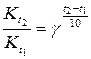 , (15)
, (15)
Влияние температуры на скорость реакции объясняет теория активных соударений Аррениуса. Основные положения теории Аррениуса:
1) молекулы реагирующих веществ представляются упругими шариками;
2) к единичному акту химического взаимодействия приводят не все соударения молекул реагирующих веществ, а только активные соударения – это соударения, в результате которых молекулы реагирующих веществ получают избыточную (дополнительную) энергию, превышающую или равную некоторой величине, которую называют энергией активации;
3) энергия активации ослабляет существующие химические связи между атомами в молекулах и создает предпосылку для перераспределения этих связей, т.е. приводит к химическому взаимодействию; энергия активации не зависит от температуры, а определяется только природой реагирующих веществ и характером химического взаимодействия;
4) скорость реакции пропорциональна количеству активных соударений; с повышением температуры тепловое движение молекул интенсифицируется, в результате доля активных соударений молекул увеличивается, а, следовательно, возрастает и скорость реакции.


При активном соударении кинетическая энергия движения молекул переходит в потенциальную, избыточная потенциальная энергия – есть энергии активации. На рис. 6 представлен график, характеризующий изменение энергии реагирующих веществ в ходе обратимой реакции (а – эндотермическая; б – экзотермическая реакция): 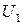 – внутренняя энергия исходных веществ;
– внутренняя энергия исходных веществ; 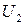 – внутренняя энергия продуктов реакции;
– внутренняя энергия продуктов реакции; 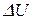 – тепловой эффект реакции;
– тепловой эффект реакции; 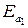 ,
, 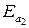 – энергия активации прямой и обратной реакций.
– энергия активации прямой и обратной реакций.
Как видно из рис. 6, энергия активации приближенно равна повышению энергии системы по сравнению с уровнем энергии исходных веществ. Тепловой эффект эндотермической реакции равен
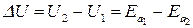 .
.
 Влияние температуры на скорость химической реакции описывает уравнение Аррениуса:
Влияние температуры на скорость химической реакции описывает уравнение Аррениуса:
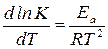 , (16)
, (16)
где 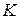 – константа скорости реакции;
– константа скорости реакции;
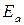 – энергия активации.
– энергия активации.
При интегрировании в интервале температур от 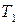 до
до 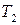 , получаем уравнение Аррениуса в интегральной форме:
, получаем уравнение Аррениуса в интегральной форме:

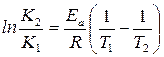 . (17)
. (17)
4.4. теория переходного состояния (активного комплекса)
Теория активных соударений не объясняет влияния на скорость реакции различных факторов (например, давления) и недостаточно точно описывает кинетику некоторых реакций. Этих недостатков лишена теория переходного состояния.
Основные положения теории переходного состояния:
1) единичные акты химического взаимодействия совершаются не мгновенно в момент соударения реагирующих молекул, а в течение некоторого времени;
2) переход от исходных веществ к продуктам реакции осуществляется через некоторое промежуточное состояние, которое называют переходным состоянием или активным комплексом;
3) активный комплекс находится в равновесии с исходными веществами, то есть лимитирующей стадией реакции является стадия распада активного комплекса.
Например, реакцию между двухатомной молекулой 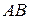 и одноатомной молекулой
и одноатомной молекулой 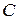 :
:
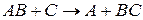
с точки зрения теории переходного состояния можно представить в виде:
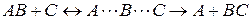 .
.
Согласно теории активного комплекса при сближении молекул 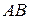 и
и 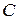 ослабляется связь
ослабляется связь 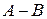 и возникает связь
и возникает связь 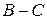 . Процесс завершается образованием молекул
. Процесс завершается образованием молекул 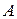 и
и 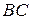 , для чего система должна пройти через активированный комплекс
, для чего система должна пройти через активированный комплекс 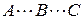 , когда атом
, когда атом 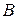 в равной степени принадлежит молекулам
в равной степени принадлежит молекулам 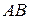 и
и 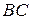 .
.
4.5. основные понятия катализа
Катализ – явление ускорения реакций в присутствии катализаторов.
Катализаторами называют вещества, которые присутствуют в реакционной смеси и изменяют скорость реакции, но сами не претерпевают никаких изменений в результате ее протекания. Если катализатор увеличивает скорость реакции, то его называют положительным, а если замедляет – отрицательным катализатором или ингибитором.
Катализаторы имеют ряд особенностей. Они не оказывают влияния на изменение энергии Гиббса и константу равновесия химической реакции, но могут сильно влиять на константу скорости реакции. Действие каждого катализатора специфично, т.е. определенные катализаторы оказывают влияние лишь на некоторые реакции. Например, серебро ускоряет реакции окисления. Для ускорения реакции достаточно очень малого количества катализатора. Смесь катализаторов часто действует значительно сильнее по сравнению с действием отдельных катализаторов. Механизм действия положительного катализатора заключается в снижении энергии активации реакции, а ингибитора – в ее увеличении.
Различают гомогенный, гетерогенный и ферментативный катализ. При гомогенном катализе катализатор и реакционная смесь составляют одну фазу, а при гетерогенном – разные фазы. При ферментативном катализе катализаторами служат вещества белковой природы (ферменты).
До настоящего времени не создано общей теории каталитических явлений, однако разработаны отдельные теории, описывающие определенные химические превращения.
Гомогенный катализ
Основной теорией гомогенного катализа является теория промежуточного соединения, согласно которой катализатор способен образовывать с реагирующими веществами нестойкие промежуточные соединения, которые затем распадаются с образованием продуктов реакции и выделением катализатора в неизменном виде. Лимитирующей стадией каталитической реакции является стадия распада промежуточного соединения.
Рассмотрим в качестве примера реакцию: 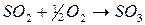 . (18)
. (18)
Эта реакция протекает очень медленно с выделением теплоты ( 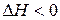 ). Увеличить скорость реакции можно двумя путями: 1. повысить температуру;
). Увеличить скорость реакции можно двумя путями: 1. повысить температуру;
2. ввести катализатор.
Если повысить температуру, константа скорости увеличится, но так как реакция экзотермическая, то согласно уравнению изобары (раздел 2.4. уравнение (14))
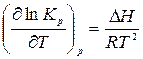
с повышением температуры снизится константа равновесия химической реакции 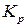 и уменьшится выход продукта реакции. Поэтому для ускорения процесса в реакционную смесь добавляют катализатор (
и уменьшится выход продукта реакции. Поэтому для ускорения процесса в реакционную смесь добавляют катализатор ( 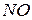 ), который в равной степени влияет на скорость прямой и обратной реакции, но не оказывают влияния на изменение энергии Гиббса и
), который в равной степени влияет на скорость прямой и обратной реакции, но не оказывают влияния на изменение энергии Гиббса и 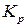 . В этом случае реакция протекает в две стадии:
. В этом случае реакция протекает в две стадии:
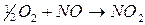 ;
; 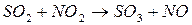 .
.
Суммируя указанные реакции, получим реакцию (17). Катализатор выделяется в неизменном виде.
Энергия активации каждой из стадий (рис. 7б) меньше энергии активации основной реакции (рис. 7а), за счет чего и повышается скорость реакции.

Таким образом, катализатор целесообразно применять для ускорения экзотермических реакций.
Гомогенно-каталитические процессы широко распространены в современных технологиях. К числу таких процессов относят:
1. кислотный катализ, в котором катализатором является кислота;
2. основный катализ (катализатор – основание).
Дата добавления: 2017-01-29; просмотров: 832;
