Примеры решения задач
Пример 1. Осуществите превращения:
Na ® NaOH ® NaHCO3 ® Na2CO3 ® Na2SO4 ® NaCl ® Na
Решение.
1) Натрий взаимодействует с водой с образованием гидроксида натрия: 2Na + 2H2O =2NaOH + H2.
2) При пропускании избытка оксида углерода (IV) через раствор гидроксида натрия можно получить гидрокарбонат натрия: NaOH + CO2 = NaHCO3
3) Карбонат натрия получается при нагревании гидрокарбоната натрия: 2NaHCO3 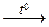 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
4) Сульфат натрия можно получить, действуя сильной серной кислотой на соль слабой угольной кислоты (сильная кислота вытесняет слабую из ее солей):
Na2CO3 +H2SO4=Na2SO4 +CO2+H2O.
5) Приливая раствор хлорида бария к раствору сульфата натрия, получим в растворе хлорид натрия:
Na2SO4+BaCl2 =2NaCl+BaSO4¯
6) Более активный металл – калий – вытесняет натрий из его солей: K + NaCl = Na + KCl
Можно также получить металлический натрий электролизом расплава NaCl: 2NaCl 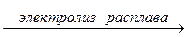 2Na + Cl2
2Na + Cl2
Пример 2. Осуществите превращения:
Cr 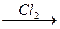 A
A 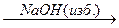 В
В 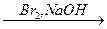 C
C
Решение.
1) Металлы реагируют с неметаллами:
2Cr + 3Cl2 = 2CrCl3 (A = CrCl3)
2) Действие избытка NaOH на соли хрома в водном растворе приводит к образованию гидроксосоли:
CrCl3 + 6NaOH = Na3[Cr(OH)6] + 3NaCl (B = Na3[Cr(OH)6])
3) При действии окислителей (Br2) степень окисления хрома (+3) переходит в степень окисления +6. В щелочной среде образуются хроматы (окислительно-восстановительная реакция):
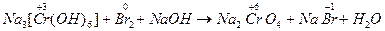
| (окислитель) | 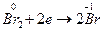
| (восстановление) | 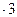
|
| (восстановитель) | 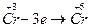
| (окисление) | 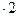
|
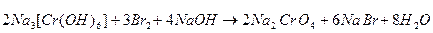 (C = Na2CrO4).
(C = Na2CrO4).
Пример 3. Напишите в молекулярной и ионной формах уравнения реакций, при помощи которых можно осуществить следующие превращения:
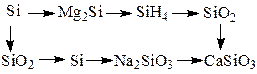
Решение.
1. Si + 2Mg 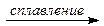 Mg2Si
Mg2Si
2. Mg2Si + 2H2SO4 → 2MgSO4 + SiH4↑
Mg2Si + 4H+ → 2Mg2+ + SiH4
3. SiH4 + 2O2 → 2H2O + SiO2
4. Si + O2 → SiO2
5. SiO2 + 2Mg → 2MgO + Si
6. Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
Si + 2OH- + H2O → SiO32- + 2H2
7. Na2SiO3 + CaCl2 → CaSiO3 + 2NaCl
SiO32- + Ca2+ → CaSiO3
8. SiO2 + Ca(OH)2 → CaSiO3 + H2O
SiO2 + 2OH- + Ca2+→ CaSiO3 + H2O
Дата добавления: 2016-11-22; просмотров: 775;
