НЕОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1. Бинарные соединения: сульфиды (Na2S, CS2), карбиды (CaC2, Al4C3), силициды (Mg2Si), нитриды (AlN), гидриды (LiH, BH3). Степени окисления серы, углерода, кремния, азота, водорода равны –1.
По своим свойствам бинарные соединения делятся на основные, кислотные и амфотерные. Например, свойства гидридов проявляются в процессе их гидролиза:
LiH + H2O = LiOH + H2 (при гидролизе основного гидрида образуется основание);
ВH3 + 3H2O = Н3ВО3 + 3H2 (при гидролизе кислотного гидрида образуется кислота);
NH3 + H2O = NH4OH (степень окисления водорода в аммиаке равна +1, это не гидрид, гидролизу не подвергается).
Бинарные соединения кислотного и основного типов взаимодействуют между собой с образованием солеподобных веществ: LiH + BH3 = Li[BH4];
Na2S + CS2 = Na2CS3.
Если в состав бинарного соединения входит амфотерный металл (например, алюминий), то образуемое соединение имеет амфотерный характер:
AlH3 + LiH = Li[AlH4];
AlH3 + BH3 = Al[BH4]3.
2. Неоксидные полимерные соединения (керамики) на основе нитридов, боридов, силицидов и др.
3. Тиокислоты и тиосоли – кислородсодержащие кислоты и соли, в которых один или несколько атомов кислорода заменены атомом серы в степени окисления –2:
Na2SO4 Na2S2O3
сульфат натрия тиосульфат натрия
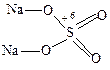
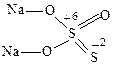
Тиосоединения проявляют обычно свойства сильных восстановителей.
4. Пероксо(пертио) соединения содержат оксо- или тио-мостики (два атома кислорода или серы, соединенные между собой):
Na2O2 – пероксид натрия; Н2О2 – пероксид водорода; FeS2 – дисульфид железа; КО2 – супероксид калия; H2SO5 – пероксосерная кислота:
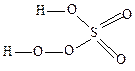
5. Поликислоты, например, полисерные и полифиофорные кислоты:
Н3РО4 + Н3РО4 = Н2О + Н4Р2О7 (дифосфорная кислота)

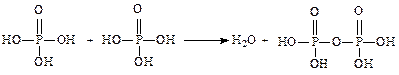
Дата добавления: 2016-11-22; просмотров: 1124;
