Примеры решения задач
Пример 4. Теплота образования сульфида меди (II) равна 48,534 кДж. Сколько теплоты выделяется при образовании 144 г сульфида меди (II)?
Решение.
Запишем термохимическое уравнение реакции:
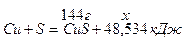
M(CuS) = M(Cu) + M(S) = 64 + 32 = 98 (г/моль)
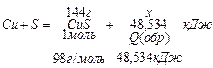
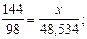
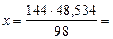 71,315 (кДж)
71,315 (кДж)
СТРОЕНИЕ ВЕЩЕСТВА
Понятие строения вещества складывается из следующих моментов: 1) строение атома; 2) строение молекул; 3) строение агрегатов молекул.
Строение атома
Атом – сложная частица, состоящая из положительно заряженного ядра и электронных оболочек, на которых помещаются отрицательно заряженные электроны.
Положительный заряд ядра равен сумме отрицательных зарядов электронов, окружающих ядро, поэтому в целом атом электронейтрален.
Атом
 |

|  Ядро Ядро
|  Электронные оболочки Электронные оболочки
| ||
| протоны (р) | нейтроны (n) | электроны (е) | ||
| Масса (кг) | 1,672×10-27 | 1,674×10-27 | 9,1×10-31 | |
| Масса (а.е.м.) | 1/1860 | |||
| Заряд (Кл) | +1,602×10-19 | –1,602×10-19 | ||
| Заряд (е) | +1 | –1 |
Протоны, нейтроны и электроны называются элементарными частицами.
Масса атома, выраженная в атомных единицах массы, называется относительной атомной массой или массовым числом атома, Мr. Она близка к сумме масс всех элементарных частиц. Так как массовые числа протона и нейтрона равны 1, а масса электрона пренебрежимо мала, то массовое число атома равно сумме числа протонов и нейтронов.
Символы химических элементов представляются обычно в виде:
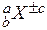 ,
,
где X – символ элемента;
a – массовое число (сумма числа протонов и нейтронов);
b – порядковый номер элемента (число протонов);
с – заряд иона.
Природные химические элементы существуют в виде смеси изотопов.
Изотопы – атомы одного химического элемента, имеющие одинаковое число протонов, но разные массовые числа (число нейтронов). Например, природный хлор существует в виде двух изотопов: 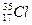 , ядро которого содержит 17 протонов и 18 нейтронов, и
, ядро которого содержит 17 протонов и 18 нейтронов, и 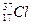 (17 протонов и 20 нейтронов). Атомная масса элемента, приведенная в периодической системе элементов, есть средняя масса его природных изотопов.
(17 протонов и 20 нейтронов). Атомная масса элемента, приведенная в периодической системе элементов, есть средняя масса его природных изотопов.
Протоны и нейтроны объединяются в компактное ядро за счет ядерных сил, возникновение которых приводит к дефекту массы (масса ядра всегда несколько меньше суммы масс протонов и нейтронов). Дефект массы определяет устойчивость атомного ядра и энергию связи нуклонов (протонов и нейтронов) в ядре.
Элементы с порядковыми номерами Z = 84 – 92 имеют только неустойчивые изотопы.
Элементы с порядковыми номерами больше 92 настолько нестабильны, что не существуют в природе, все они были получены искусственным путем.
Самопроизвольное разложение атомных ядер неустойчивых изотопов носит название «радиоактивность», а реакции, которые протекают в этих случаях – ядерные реакции.
Примеры ядерных реакций.
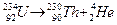 – выделение a-частиц;
– выделение a-частиц;
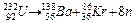 – выделение нейтронов;
– выделение нейтронов;
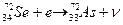 (нейтрино) – электронный захват.
(нейтрино) – электронный захват.
Дата добавления: 2016-11-22; просмотров: 707;
