КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Основные классы
ОКСИДЫ
Оксиды – это сложные бинарные вещества, содержащие атомы кислорода в степени окисления –2.
  ОКСИДЫ ОКСИДЫ
| |||||
   Солеобразующие Солеобразующие
| Несолеобразующие (безразличные) | ||||
 Основные Основные
|  Амфотерные Амфотерные
|  Кислотные Кислотные
| 
| ||
| Оксиды металлов в низших сте-пенях окис-ления (с.о.)+1 и +2: Na2O, FeO, MgO | Некоторые оксиды ме-таллов в с.о. +2, +3 и +4: BeO, ZnO, PbO, SnO, Al2O3, Cr2O3 | Оксиды неметаллов в с.о. +3 и выше, а также оксиды металлов в с. о. +4 и выше: В2О3, СО2, P2O5, PbO2, CrO3 | Оксиды неметаллов в степенях окисления +1 и +2: СО, SiO, N2O, NO | ||
Увеличение степени окисления неметалла приводит к изменению свойств его оксида от несолеобразующего к кислотному:
| N2O | NO | N2O3 | NO2 | N2O5 |
| Несолеобразующие оксиды | Кислотные оксиды |
Увеличение степени окисления металла приводит к изменению свойств его оксида от основного к амфотерному и дальше – к кислотному:
| MnO | Mn2O3 | MnO2 | MnO3 | Mn2O7 |
| Основные оксиды | Амфотерный оксид | Кислотные оксиды |
Химические свойства оксидов:
1. Основные и кислотные оксиды растворяются в воде в том случае, если в результате реакции образуются растворимые в воде основания и кислоты:
| Na2O + H2O = 2NaOH | C водой взаимодействуют оксиды щелочных и щелочноземельных металлов |
| CaO + H2O = Ca(OH)2 | |
| FeO + H2O ¹ | |
| SO3 + H2O = H2SO4 | C водой взаимодействуют кислотные оксиды, которым соответствуют растворимые кислоты |
| P2O5 + H2O (хол.) = 2НРО3 | |
| P2O5 + 3H2O (гор.) = 2Н3РО4 | |
| 2NO2 + H2O = HNO2 + HNO3 | |
| 4NO2 + O2 + 2H2O = 4HNO3 | |
| СrO3 + H2O = H2CrO4 | |
| SiO2 + H2O ¹ |
2. Основные и кислотные оксиды взаимодействуют между собой:
| Na2O + СО2 = Na2СО3 | Если кислотный оксид газообразный, реакция идет при комнатной температуре |
| CaO + SO2 = CaSO3 | |
Na2O + SiO2 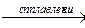 Na2SiO3 Na2SiO3
| Если кислотный оксид твердый, реакция идет при нагревании (сплавлении) |
FeO + PbO2 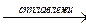 FePbO3 FePbO3
| |
3. Амфотерные оксиды взаимодействуют как с основными, так и с кислотными оксидами:
ZnO + Na2O 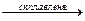 Na2ZnO2 Na2ZnO2
| Al2O3 + K2O 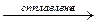 2KAlO2 2KAlO2
| ||
| ZnO + CO2 = ZnCO3 | Al2O3+3SiO2 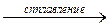 Al2(SiO3)3 Al2(SiO3)3
| ||
Реакции оксидов между собой в стехиометрическом соотношении возможны только в том случае, если их свойства значительно различаются.
В противном случае возможно образование соединений нестехиометрического состава:
x CaO + y Al2O3 = x CaO×y Al2O3 (двойные оксиды – основа керамик).
По составу керамики делятся на:
а) алюмосиликатные (тройные оксиды, состоящие из оксидов алюминия, кремния и двухвалентного металла)
x Al2O3×y SiO2×z MO
б) магнезиальные (на основе оксида магния);
в) титанатные (на основе TiO2) и некоторые другие.
4. Основные и амфотерные оксиды взаимодействуют с кислотами: MgO + 2HCl = MgCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
5. Кислотные и амфотерные оксиды взаимодействуют со щелочами: SO2 + 2NaOH = Na2SO3 + H2O
ZnO + 2NaOH 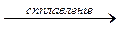 Na2ZnO2 + H2O
Na2ZnO2 + H2O
ZnO + 2NaOH + H2O 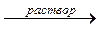 Na2[Zn(OH)4]
Na2[Zn(OH)4]
Al2O3 + 2NaOH 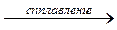 2NaAlO2 + H2O или
2NaAlO2 + H2O или
Al2O3 + 6NaOH (изб.) 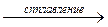 2Na3AlO3 + 3H2O
2Na3AlO3 + 3H2O
Al2O3 + 2NaOH + 7Н2О 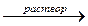 2Na[Al(OH)4(H2O)2] или
2Na[Al(OH)4(H2O)2] или
Al2O3 + 6NaOH (изб.) + 3H2O 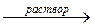 2Na3[Al(OH)6]
2Na3[Al(OH)6]
ОСНОВАНИЯ
Основания – это сложные вещества, которые при диссоциации образуют катионы металлов (или аммония NH4+) и гидроксид-анионы ОН–.
Классификация оснований: 1) растворимые в воде (щелочи) – это основания щелочных (элементы IA группы) и щелочноземельных (элемненты больших периодов IIA группы), например NaOH, KOH, Ca(OH)2, Ва(ОН)2.
2) растворимое в воде слабое олснование – гидроксид аммония, NH4OH.
3) нерастворимые в воде основания, например Fe(OH)2.
4) амфотерные основания, которые соответствуют амфотерным оксидам, например Zn(OH)2, Al(OH)3 и др.
Число групп ОН–, входящих в состав основания, определяет его кислотность. Например, КОН – однокислотное основание, Са(ОН)2 – двухкислотное основание, Al(OH)3 – трехкислотное основание.
Химические свойства оснований:
Щелочи:
1) реагируют с кислотными оксидами и кислотами:
| 2КОН + SO3 = K2SO4 + H2O | Реакция нейтрализации |
| Ca(OH)2 + 2HCl = CaCl2 + 2H2O |
2) реагируют с солями (в том случае, если в процессе реакции образуется осадок):
2NaOH + FeCl2 = Fe(OH)2¯ + 2NaCl
Ba(OH)2 + Na2SO4 = BaSO4¯ + 2NaOH
NaOH + BaCl2 ¹
3) реагируют с амфотерными оксидами и основаниями:
2NaOH + BeO 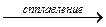 Na2BeO2 + H2O
Na2BeO2 + H2O
3NaOH + Cr(OH)3 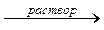 Na3[Cr(OH)6]
Na3[Cr(OH)6]
Нерастворимые основания:
1) реагируют с кислотными оксидами и кислотами (реакция нейтрализации):
Fe(OH)3 + 3HNO3 = Fe(NO3)3 + 3H2O
2) реагируют со щелочами:
CuSO4+2NaOH=Cu(OH)2¯+Na2SO4
3) разлагаются при нагревании: Cu(OH)2 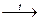 CuO + H2O
CuO + H2O
Амфотерные основания:
1) реагируют с кислотными оксидами и кислотами (реакция нейтрализации): Zn(OH)2 + CO2 = ZnCO3 + H2O
2) реагируют со щелочами:
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
4) разлагаются при нагревании:
2Al(OH)3 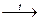 Al2O3 + 3H2O
Al2O3 + 3H2O
КИСЛОТЫ
Кислоты – это сложные вещества, которые при диссоциации образуют катионы водорода Н+ и анионы кислотного остатка. Названия некоторых из них приведены ниже:
| Кислота | Название | Кислотный остаток | Название |
| HCl | хлороводородная (соляная) | Cl– | хлорид |
| HBr | бромоводородная | Br– | бромид |
| HI | иодоводородная | I– | иодид |
| H2S | сероводородная | HS– | гидросульфид |
| S2– | сульфид | ||
| H2SO3 | сернистая | HSO3– | гидросульфит |
| SO32– | сульфит | ||
| H2SO4 | серная | HSO4– | гидросульфат |
| SO42– | сульфат | ||
| HNO2 | азотистая | NO2– | нитрит |
| HNO3 | азотная | NO3– | нитрат |
| H3PO4 | (орто)фосфорная | H2PO4– | дигидрофосфат |
| HPO42– | гидрофосфат | ||
| PO43– | (орто)фосфат | ||
| HPO3 | метафосфорная | PO3– | метафосфат |
| H2CO3 | угольная | HCO3– | гидрокарбонат |
| CO32– | карбонат | ||
| H2SiO3 | кремниевая | HSiO3– | гидросиликат |
| SiO32– | силикат | ||
| CH3COOH | уксусная | CH3COO– | ацетат |
| H2CrO4 | хромовая | CrO42– | хромат |
| H2Cr2O7 | двухромовая | Cr2O72– | дихромат |
| HMnO4 | марганцевая | MnO4– | перманганат |
| HClO4 | хлорная | ClO4– | перхлорат |
Основность кислоты (число атомов водорода) определяет возможность полной или неполной нейтрализации кислоты при реакции с основаниями: HCl + NaOH = NaCl + H2O (для одноосновных кислот возможна только одна реакция нейтрализации, приводящая к образованию средних солей).
Для многоосновных кислот возможна полная и неполная нейтрализация: H2СО3 + 2КОН (изб.) = К2СО3 + 2Н2О
(полная нейтрализация – образование средней соли)
H2СО3 + КОН (недост.) = КНСО3 + Н2О
(неполная нейтрализация – образование кислой соли)
Химические свойства кислот:
1. Изменение окраски индикаторов (лакмуса и метилоранжа).
2. Взаимодействие с металлами: Са + 2HCl = CaCl2 + H2
3. Взаимодействие с основными и амфотерными оксидами:
СuO + 2HNO3 = Cu(NO3)2 + H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
4. Взаимодействие с основаниями (реакция нейтрализации):
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
5. Взаимодействие с солями (реакции обмена):
H2SO4 + BaCl2 = 2HCl + BaSO4¯ (осадок)
2HNO3 + СаСО3 = Ca(NO3)2 + H2O + CO2 (газ)
HCl + KNO2 = KCl + HNO2 (сильная кислота вытесняет слабую из ее соли)
СОЛИ
Соли – это сложные вещества, которые при диссоциации образуют катионы металла (или NН4+) и анионы кислотного остатка.
Соли можно рассматривать как продукты замещения атомов водорода в молекуле кислоты на металл или гидроксильных групп в молекуле основания на кислотный остаток.
При растворении в воде ионы соли захватывают и удерживают определенное число молекул воды. Для ряда солей силы взаимодействия с молекулами воды так велики, что последние остаются в составе соли даже при выпаривании раствора. При этом соотношение между количеством вещества соли и воды постоянны для данной соли. Такие соединения называют кристаллогидратами, а вода – кристаллизационной: BaCl2×2H2O – дигидрат хлорида бария, СuSO4×5H2O – пентагидрат сульфата меди (медный купорос).
Химические свойства солей:
1. Взаимодействие с металлами (реакции замещения – более активный металл вытесняет менее активный):
FeCl2 + Zn = Fe + ZnCl2.
2. Взаимодействие с неметаллами (реакции замещения – более активный неметалл вытесняет менее активный):
2NaBr + Сl2 = Br2 + 2NaCl.
3. Взаимодействие сo щелочами (реакции обмена):
MgCl2 + 2NaOH = Mg(OH)2¯ + 2NaCl.
4. Взаимодействие с недостатком щелочей (перевод средних солей в основные): CaCl2 + NaOH (недост.) = CaOHCl + NaCl.
5. Взаимодействие с кислотами (реакции обмена):
СаCl2 + H2SO4 = CaSO4¯ + 2HCl.
6. Взаимодействие с избытком кислоты или кислотного оксида (перевод средних солей в кислые):
Na2SO4 + H2SO4 (изб.) = 2NaHSO4
CaCO3¯ + CO2 + H2O = Ca(HCO3)2
7. Взаимодействие солей между собой (реакции обмена):
CuCl2 + 2AgNO3 = 2AgCl¯ + Cu(NO3)2.
Дата добавления: 2016-11-22; просмотров: 953;
