Классификация, состав, номенклатура оксидов, кислот, оснований. Способы получения и их химические свойства. 1 страница
План:
I. Оксиды.
1. Классификация и номенклатура оксидов.
2. Изменение характера оксидов при увеличении степени окисления металла.
3. Физические свойства.
4. Химические свойства.
а) кислотно-основные свойства;
б) окислительно-восстановительные свойства
5. Способы получения.
II. Основания.
1. Классификация и номенклатура оснований.
2. Физические свойства оснований.
3. Химические свойства оснований:
а) реакции нейтрализации;
б) свойства нерастворимых оснований;
в) свойства растворимых оснований.
4. Способы получения:
а) щелочей;
б) не растворимых оснований.
III. Кислоты.
1. Классификация и номенклатура кислот.
2. Физические свойства кислот.
3. Химические свойства:
а) общие свойства;
б) специфические свойства.
4. Способы получения.
I. Оксиды.
1. Классификация и номенклатура оксидов.
Оксиды - соединения двух элементов, один из которых кислород в степени окисления - 2.
| Оксиды | Несолеобразующие (безразличные, индифферентные) СО, SiO, N2O, NO | |
| Солеобразующие | ||
| Основные | Амфотерные | Кислотные |
| Оксиды, гидраты которых являются основаниями. Оксиды металлов со степенями окисления +1 и +2 (реже +3). Примеры: Na2O - оксид натрия, СuО - оксид меди (II), Мn2О3 - оксид марганца (III) | Оксиды, гидраты которых являются амфотерными гидроксидами. Оксиды металлов со степенями окисления +3 и +4 (реже +2). Примеры: Аl2Оз - оксид алюминия, Сr2О3 - оксид хрома (III), МnО2 - оксид марганца (IV). | Оксиды, гидраты которых являются кислородосодержащими кислотами. Оксиды неметаллов. Пример: Р2O3 - оксид фосфора(Ш), N2O5 - оксид азота (V), SO3 - оксид серы (VI). Оксиды металлов со степенями окисления +5,+6,+7. Пример: Sb2O5 - оксид сурьмы (V), СгОз - оксид хрома (VI), Мn2О7 - оксид марганца (VII). |
2. Изменение характера оксидов при увеличении степени окисления металла.
| +2 СrO (осн.) | +3 Cr2O3 (амф.) | +6 СrО3 (кисл.) |
 +2
MnO, (осн.)
+3
Mn2O3 +2
MnO, (осн.)
+3
Mn2O3
| +4 МпO2 | +6 МnO3, (кисл.) +7 Mn2O7 |
3. Физические свойства. Агрегатное состояние
| Твердые | Жидкие | Газообразные |
| CaO, CuO, Li2O и др. осн. оксиды; ZnO, A12O3, Cr2O3 и др. амф. оксиды; SiO2, Р2О5, СгОз и др. кисл. оксиды | SО3, С12О7, Мn2О7 и др. | CO2, SO2, N2O, NO2 и др. |
Растворимость в воде
| Растворимые | Нерастворимые |
| а) основные оксиды щелочных и щелочноземельных металлов; б) практически все кислотные оксиды (исключение SiО2) | а) все остальные основные оксиды; б) все амфотерные оксиды; в) SiО2 |
4. Химические свойства.
а) кислотно-основные свойства.
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые иллюстрируются следующей схемой:
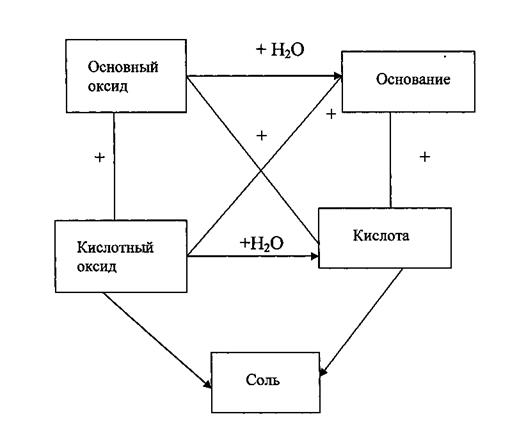
Примеры:
Только для оксидов щелочных и щелочноземельных металлов (кроме SiО2)
СаО (основный оксид) + Н2O = Са(ОН)2 (основание)
SO3 (кислотный оксид) + Н2O = H2SО4 – кислота
СаО (основный оксид) + SO3 (кислотный оксид) = CaSО4 (соль)
СаО (основный оксид) + H2SО4 = CaSО4 (соль) + Н2О
SО3 (кислотный оксид) + Са(ОН)2 = CaSО4 (соль) + Н2О
б) окислительно-восстановительные свойства
Если элемент имеет переменную степень окисления (со.), то его оксиды с
низкими со. могут проявлять восстановительные свойства, а оксиды с высокими
со. - окислительные.
Примеры реакций, в которых оксиды выступают в роли восстановителей:
+2 t +4
2CO + О2 = 2CО2
t, кат.
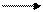 +4 +6 +4 +6
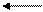 2SО2 + О2 2SО3
+2 +4
2NО + О2 = 2NО2 2SО2 + О2 2SО3
+2 +4
2NО + О2 = 2NО2
| Окисление оксидов с низкими со. до оксидов с высокими со. элементов. |
| +2 t +4 CO + FeO = Fe + CО2 +2 t +4 co + h2o = h2 + co2 | Оксид углерода (II) восстанавливает металлы из них оксидов и водород из воды. |
Примеры реакции, в которых оксиды выступают в роли окислителей:
| +4 t +2 CO2 + С = 2CO +6 +4 3SO3 + H2S=4SO2 + H2O +4 t 0 CO2 + 2Mg = С + 2MgO +2 t 0 CuO + H2 = Cu + H2O | Восстановление оксидов с высокими с.о. элементов до оксидов с низкими со. или до простых веществ |
  О
+2 t 0 О
+2 t 0
  CuO + CH3CH2OH CH3C + Cu + H2O
H CuO + CH3CH2OH CH3C + Cu + H2O
H
 О О
  +1 t 0 +1 t 0
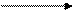  Ag2О + CH3C NH4OH СН3СООН + 2Ag
H Ag2О + CH3C NH4OH СН3СООН + 2Ag
H
| Использование. оксидов малоактивных металлов для окисления органических веществ. |
Некоторые оксиды, в которых элемент имеет промежуточную со., способны к диспропорционированию; например:
+4 +3 +5
2NО2 + 2NaOH = NaNО2 + NaNО3 + Н2О
5. Способы получения.
1. Взаимодействие простых веществ - металлов и неметаллов - с кислородом:
4Li + О2 = 2Li2О
t
2Cu + О2 = 2CuO
4P + 5О2 = 2P2O5
2. Дегидратация нерастворимых оснований, амфотерных гидроксидов и
некоторых кислот: t
Cu(OH)2 = CuO + H2О
t
2А1(ОН)3 = А12О3 + 3Н2О
t
 H2SО3 = SО2 + Н2О
H2SО3 = SО2 + Н2О
t
H2ОH2SiО3 = SiO2 + H2O
3. Разложение некоторых солей:
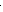 t
t
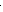 2Cu(NО3)2 = 2CuO + 4NO2 + О2
2Cu(NО3)2 = 2CuO + 4NO2 + О2
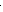 t
t
СаСОз = CaO + СО2
t
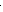 (CuOH)2CО3 = 2CuO + CО2 + H2О
(CuOH)2CО3 = 2CuO + CО2 + H2О
4. Окисление сложных веществ кислородом:
t
СН4 + 2О2 = СО2 + 2Н2О
t
4FeS2 + 11O2 = 2Fe2О3 + 8SО2
t, кат.
4NH3 + 5О2 = 4NO + 6H2О
5. Восстановление кислот-окислителей металлами и неметаллами:

Сu + 2 H2SO4 (конц.) = CuSO4 + SO2 + 2H2O

10HNO3 (конц.) + 4Ca = 4Ca(NO3)2 + N2O + 5H2O

2HNO3 (разб.) + S = H2SO4 + 2NO
6. Взаимодействие оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
II. Основания.
1. Классификация и номенклатура оснований.
Основания - это электролиты, которые при диссоциации в водных растворах образуют только один вид анионов - гидроксиды-ионы ОН-:

 МеОН Ме+ + ОН-
МеОН Ме+ + ОН-
(Ме+ - катион металла)
а) по кислотности:
— Однокислотные (NaOH, КОН, NH4OH и др.);
— Двухкислотные (Са(ОН)2, Cu(OH)2, Fe(OH)2 и др.);
— Трехкислотные (Ni(OH)3, Со(ОН)3, Мn(ОН)3 и др.).
б) по растворимости в воде и степени ионизации:
— Растворимые в воде сильные основания (щелочи) - гидроксиды щелочных и
щелочноземельных металлов:
LiOH - гидроксид лития
NaOH - гидроксид натрия (едкий натр) КОН - гидроксид калия (едкий калий) RbOH - гидроксид рубидия
CsOH - гидроксид цезия
Са(ОН)2 - гидроксид кальция
Sr(OH)2 - гидроксид стронция
Ва(ОН)2 - гидроксид бария;
— Нерастворимые в воде слабые основания, например:
Сu(ОН)2 - гидроксид меди (II)
Fe(OH)2- гидроксид железа (II) Ni(OH)3 - гидроксид никеля (III)
2. Физические свойства.
Все основания (гидроксиды металлов) - твердые вещества. Растворимость в воде -см. выше. Гидроксиды s-металлов бесцветны, гидроксиды d-металлов окрашены.
3. Химические свойства.
а) реакции нейтрализации (общим свойством оснований является их способность взаимодействовать с кислотами с образованием солей) Если в реакциях нейтрализации участвуют многокислотные основания или многоосновные кислоты, то в зависимости от молярного соотношения основания и кислоты могут образовываться либо нормальные, либо кислые, либо основные соли. Например:
NaOH + НС1 = NaCl + Н2O
OH- + H+= Н2О
 Сu(ОН)2 + 2НNO3 Cu(NO3)2 + 2Н2O
Сu(ОН)2 + 2НNO3 Cu(NO3)2 + 2Н2O
 Сu(ОН)2 + 2H Сu2++2Н2O
Сu(ОН)2 + 2H Сu2++2Н2O
 2КОН + Н3РO4 K2HPO4+2H2O
2КОН + Н3РO4 K2HPO4+2H2O
 2OН- + Н3РO4 НРO42- + 2Н2O
2OН- + Н3РO4 НРO42- + 2Н2O
 Ni(OH)3 + H2SO4 NiOHSO4+2H2O
Ni(OH)3 + H2SO4 NiOHSO4+2H2O
 N(ОН)3 + 2Н+ NiOH++2H2O
N(ОН)3 + 2Н+ NiOH++2H2O
б) свойства нерастворимых оснований (в отличие от растворимых оснований, т.е.
щелочей)
1. Нерастворимые основания подвергаются термической дегидрации; например:
t
Сu(ОН)2 = СuО + Н2O
2СO(ОН)3 = СO2O3 + ЗН2O
Гидроксиды некоторых металлов разлагаются при обычной температуре, т.е. являются неустойчивыми, например:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
2. Гидроксиды, в которых d-металлы имеют низкие с.о., способны окисляться кислородом воздуха; например:
4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3
2Мn(ОН)2 + O2 + 2H2O = 2Mn(OH)4
4. Гидроксиды d-металлов вступают в реакции комплексообразования; например:
Cu(OH)2 + 4NH3 = [Cu(NH3)4] (OH)2
Cu(OH)2 + 2NaOH (конц.) = Na2[Cu(OH)4]
(Последняя реакция свидетельствует о проявлении гидроксидом меди (II) признаков амфотерности).
в) свойства растворимых оснований (в отличие от нерастворимых оснований)
1. Растворы щелочей взаимодействуют с кислотными и амфотерными оксидами, а также с амфотерными гидроксидами:
2NaOH + СO2 = Na2CO3 + Н2O
2КОН + А12O3 + ЗН2O = 2К[Аl(ОН)4]
2КОН + Zn(OH)2 = K2[Zn(OH)4]
2. Растворы щелочей вступают в обменные реакции с растворами солей, если в
результате образуется слабое основание или нерастворимая соль:

2NaOH + FeCl2 = Fe(OH)2 + 2NaCl 2OH + Fe2+ = Fe(OH)2

Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH
Ba2+ + SO42- = BaSO4
NaOH + NH4Cl = NaCl + NH3↑ + H2O

 NH4 OH
NH4 OH
OH- + NH+4 = NH3 + H2O
3. Растворы щелочей взаимодействуют с металлами, образующими амфотерные
оксиды и гидроксиды (Zn, A1, и др.); например:
 0 +1 +2 0
0 +1 +2 0
Zn + 2NaOH + 2Н2O = Na2[Zn(OH)4] + Н2
 0 +1 +3 0
0 +1 +3 0
2А1 + 2КОН + 6Н20 = 2К[А1(ОН)4] + 3Н2
4. В растворах щелочей некоторые металлы диспропорционируют; например:
о -1 +1
С12 + 2NaOH = NaCl + NaClO + Н2O
0 t -2 +4
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
 0 -3 +1
0 -3 +1
4P + 3KOH + 3H2O = PH3 + 3KH2PO2
5. Растворимые основания широко используются в реакциях щелочного гидролиза
различных органических соединений (галогенпроизводных углеводородов,
сложных эфиров, жиров и др.); например:
t0
 С2Н5С1 (хлорэтан) + NaOH С2Н5ОН (этанол) + NaCl
С2Н5С1 (хлорэтан) + NaOH С2Н5ОН (этанол) + NaCl
 O
O
 СН3С
СН3С  + КОН СН3СООК + С2Н5ОН
+ КОН СН3СООК + С2Н5ОН
O - С2Н5 ацетат калия этанол
Этилацетат
6. Спиртовые растворы щелочей участвуют в реакциях дегидрогалогенирования
органических соединений; например:
t
 СН3СН2СН2С1+КОН СН3СН=СН2 + КС1 + Н2O
СН3СН2СН2С1+КОН СН3СН=СН2 + КС1 + Н2O
1-хлорпропан (спирт.) пропен
 СН3-СН-СН2 + 2КОН СН3-С=СН + 2КВг + 2Н2O
СН3-СН-СН2 + 2КОН СН3-С=СН + 2КВг + 2Н2O

 (спирт.) пропин
(спирт.) пропин
Вr Вr
1, 2-дибромпропан
4. Способы получения.
Способы получения щелочей и нерастворимых оснований различны.
а) способы получения щелочей:
1. Растворение соответствующих оксидов в воде:
Na2O + Н2O = 2NaOH
ВаО + Н2O =Ва(ОН)2
2. Растворение соответствующих щелочных или щелочноземельных металлов в
воде:
 2К + 2Н2O = 2КОН + Н2
2К + 2Н2O = 2КОН + Н2

Са + 2Н2O = Са(ОН)2 + Н2
3. Электролиз водных растворов солей и щелочных и щелочноземельных металлов:

 эл.ток
эл.ток
 СаС12 + 2Н2O Са(ОН)2 + Н2 + С12
СаС12 + 2Н2O Са(ОН)2 + Н2 + С12
4. Взаимодействие гидроксидов кальция и бария с растворами солей щелочных
металлов (соответственно, карбонатами и сульфатами):
 t
t
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3
 K2SO4 + Ba(OH)2 = 2KOH + BaSO4
K2SO4 + Ba(OH)2 = 2KOH + BaSO4
б) способы получения нерастворимых оснований:
Осаждение из растворов соответствующих солей щелочами:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
FeCl3 + 3KOH = Fe(OH)3 + 3KC1
Для некоторых нерастворимы оснований существуют специфические способы получения (окислительно-восстановительные реакции, необратимый гидролиз солей).
III. Кислоты.
1. Классификация и номенклатура кислот.
Кислоты - это электролиты, которые при диссоциации в водных растворах образуют только один вид катионов - ионы водорода H+:
 НАс Н+ + Ас- (Ас - кислотный остаток)
НАс Н+ + Ас- (Ас - кислотный остаток)
1. По основности:
— Одноосновные (НС1, HCN, HNO3, HClO4 и др.);
— Многоосновные:
Двухосновные (H2S, H2SO4, Н2СrO4);
Трехосновные (H3PO4, H3AsO4 и др.);
Четырехосновные (Н4Р2O7 и др.).
2. По содержанию атомов кислорода в молекулах кислот:
| Бескислородные | ________ Кислородосодержащие_____ |
| HF - фтороводородная (плавиковая) НС1 - хлороводородная (соляная) НВг - бромоводородная HI - иодоводородная H2S - сероводородная HCN - циановодородная (синильная) HNCS - тиоциановая (роданистоводородная) | Н3ВО - ортоборная Н2СО3 - угольная Н2SiO3 - кремниевая НNОз - азотная HNO2 - азотистая Н3РО4 - ортофосфорная Н2НРО3 - фосфористая (двухосновная к-та) H2SO4 - серная H2SO3 - сернистая НСlO4 - хлорная НСlOз - хлорноватая HCIO2 - хлористая НСlO - хлорноватистая Н2СlO4 - дихроматовая Н2Сr2О7 - дихромовая НМnО4 - марганцовая |
3. По степени диссоциации в водных растворах:
— Сильные кислоты (НС1, HBr, H1, HNO3, H2SO4, НСlO4, Н2СlO3, Н2CrO4, Н2Сг2O7, НМnO4);
— Слабые кислоты (HF, H2S, HCN, H3BO3, H2CO3, H2SiO3, HNO2, H3PO4, H2HPO3, H2SO3, НСlO2, НСlO).
2. Физические свойства.
| Агрегатное состояние | ||
| Растворы газов в воде | Жидкие | Твердые |
| HF, НС1, НВr, Hl, H2S HCN, H2CO3, H2SO3 | HNO3, H2SO4, НСlO4, НС1O3 | H3BO3, H2SiO3, Н3РO4 Н3РO3 |
Все жидкие и твердые кислоты (кроме H2SiO3) растворимы в воде.
3. Химические свойства
а) общие свойства.
Общие свойства кислот обусловлены наличием в их водных растворах избытка ионов водорода Н+. К этим свойствам относятся:
— Взаимодействие с основаниями (реакции нейтрализации).
— Взаимодействие с основными оксидами
2НС1 + MgO = MgCl2 + Н2O
2Н+ + MgO = Mg2+ + Н2O
H2SO + FeO = FeSO4 + Н2O
2H+FeO = Fe2+ + H2O
— Взаимодействие с амфотерными оксидами и гидроксидами
6HNO3 + А12O3 = 2A1(NO3)3 + ЗН2O
6Н+ + А12O3 = 2А13+ + ЗН2O
2НВг + Zn(OH)2 = ZnBr2 + 2Н2O
2H++ Zn(OH)2 = Zn2+ + 2H2O
— Взаимодействие с металлами, расположенными в ряду напряжений до
водорода
2НС1 + Zn = ZnCl2 +Н2↑ (2Н+ + Zn° = Zn2+ + Н°2)

Н2SO4(разб.)+Fe =Fe4 + H2 (2H+ +Fe° = Fe2+ H°2)
(Реакции концентрированной серной, разбавленной и концентрированной азотной кислотой с металлами протекают без участия ионов Н+ и относятся к специфическим свойствам этих кислот).
— Взаимодействие с солями более слабых или более летучих кислот

2НС1 + Na2CO3 = 2NaCl + СO2 + Н2O
2Н+ + СO2-3 = СO2 + Н2O
H2SO4(paзб.) + FeS = FeSO4 + H2S↑
2H+ + FeS = Fe2+ + H2S
б) специфические свойства
Специфические свойства кислот обусловлены химическим характером входящих в их состав анионов. К этим свойствам относятся:
1. Качественные реакции на анионы некоторых кислот; например:
НС1 + AgNO3 = AgCl(6eлый)↓ + HNO3
Сl- + Ag+ = AgCl
H2SO4 + BaCl2 = ВаSO4(белый)↓ + 2НС1
SO42+ + Ba2+ = BaSO4
2. Реакции, в которых анионы кислот играют роль окислителей; например:
+5 0 +2 +4
4НNO3(конц.) + Сu = Cu(NO3)2 + 2NO2↑ + 2H2O
+5 0 +5 +2
5НNO3(разб.) + 3 Р + 2Н2O = 3Н3РO4 + 5NO
3. Реакции, в которых анионы кислот играют роль восстановителей; например:
 -1 +7 0
-1 +7 0
16НС1 + 2КМnO4 = 2МnС12 + 5С12 + 2КС1 + 8Н2O
-1 0 hv 0 -2
4HI +O2 = 2I2 + 2Н2O
4. Реакции нитрования (с участием HNO3) и сульфирования (с участием H2SO4)
органических соединений, а также реакции этерификации с участием
неорганических кислот.
4. Способы получения.
Бескислородные кислоты получают растворением в воде соответствующих летучих водородных соединений неметаллов, которые синтезируют из простых веществ:
Дата добавления: 2016-11-22; просмотров: 2674;
