Валентность элементов.
Валентность элементов - это число химических связей, которые атом этого элемента образует с другими атомами в данной молекуле. Валентность элемента определяется числом неспаренных электронов в его атоме.
Атомы многих элементов могут увеличивать свою валентность в результате перехода из основного состояния в возбужденное состояние, то есть состояние с более высокой энергией, чем основное.
Процесс перехода атома из основного в возбужденное состояние называется возбуждением атома, происходит разъединение спаренных электронов и переход одного из них с данного подуровня на свободную орбиталь другого подуровня в пределах одного энергетического уровня.
Например, атом углерода в основном состоянии является двухвалентным, так как из четырех электронов внешнего электронного слоя (2s2 2p2) только два являются неспаренными:
 | |||
 |
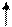
 6С свободная орбиталь
6С свободная орбиталь
2p

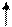
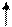
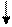 2s
2s
При поглощении энергии E один из электронов 2s подуровня переходит на свободную орбиталь 2p – подуровня, в результате чего образуется четыре неспаренных электрона:














 + E
+ E
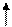 |
2p 2p 2s12p3
 2s 2s
2s 2s
В возбужденном состоянии углерод является четырехвалентным.
Энергия возбуждения атомов компенсируется энергией образования новых химических связей.
Возбуждение атомов возможно не для всех элементов.
Например, атомы кислорода и серы имеют одинаковую конфигурацию внешнего электронного слоя s2 p 4 , так как кислород и сера находится в главной подгруппе VI группы. В невозбужденном состоянии имеют по два неспаренных электрона на внешнем электронном слое:
 | |||
 |
8О 16 S 3 d





 2p 3p
2p 3p
2s 3s
В основном состоянии кислород и сера имеют одинаковую валентность, равную двум. Но атом серы может перейти в возбужденное состояние за счет перехода электронов с 3s и 3p – подуровней на свободные орбитали 3d –подуровня:
S










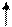 + Е
+ Е








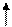
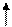

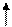
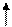



 3d S * 3d
3d S * 3d


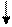
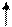
 3p 3p
3p 3p
3s основное состояние + E
 В II 3s
В II 3s
3s23p4 S *
Возбужденное состояние В IV
 3d
3d
3p
Возбужденное
3s 3s13p33d2 состояние B VI
Это является причиной переменной валентности серы. Атом кислорода не может перейти в возбужденное состояние, потому что на втором энергетическом уровне отсутствует d – подуровень, т.е. нет свободных орбиталей, что и является причиной постоянной валентности кислорода во всех соединениях.
Для большинства элементов максимальное число неспаренных электронов в основном или в возбужденном состоянии равно номеру группы, в которой находится элемент.
Высшая валентность элементов, как правило, равно номеру группы (исключения рассмотрены ранее).
Следовательно, валентность элемента определяется числом орбиталей, которые атом данного элемента может использовать для образования химических связей.
Это могут быть: орбитали с неспаренными электронами; орбитали с неподелнными электронными парами; свободные орбитали.
Степень окисления
Степень окисления – это одно из основных понятий химии. Оно характеризует состояние атома в соединении. Степень окисления – это условный заряд атома в соединении, вычисленный, исходя из предположения, что оно состоит только из ионов. Степень окисления может быть положительной (+), отрицательный (-) и нулевой. Обозначается арабскими цифрами, которые ставят над символом элемента +1 -2 0
(Na2O; CL2).
Положительная степень окисления показывает, сколько электронов нейтральный атом отдал при образовании химической связи:
0 _ +6
 S – 6е S
S – 6е S
Максимальная положительная степень окисления обычно равна номеру группы.
Отрицательная степень окисления показывает, сколько электронов нейтральный атом присоединил при образовании химической связи.
0 _ -2
 S + 2е S
S + 2е S
При определении степени окисления элемента в соединении необходимо помнить: степень окисления водорода во всех соединениях за исключением гидридов металлов (Na+1H-1, Li+1H-1, Ca+2H-1 и др.) равна «+1», H+1; степень окисления кислорода во всех соединениях равна «-2», О-2 за исключением пероксидов водорода и металлов (О+2F-12 H+12O-12 Na+12O-12 Ca+2O-12 и др.); металлы в соединениях всегда имеют положительную степень окисления – щелочные (Li, Na, K и др. ) «+1» , щелочноземельные (Ca, Ba и др. II группы, кроме ртути) - «+2» , алюминий - «+3» ; фтор – «-1» ; степень окисления атомов в простых веществах всегда равна нулю (O02 H02 и тд.) – это элементы, имеющие постоянную степень окисления.
Элементы с переменной степенью окисления: медь (+1) и (+2), железо (+2) и (+3), ртуть (+1) и (+2) .
Все элементы имеют высшую степень окисления, которая, как правило, равна номеру группы П.С.; низшую (минимальную) степень окисления у металлов равная нулю, у неметаллов равна – (8 – номер группы, в которой находится элемент); значения степеней окисления между высшей и низшей степенями окисления называются промежуточными (азот: низшая (-3) , промежуточные (-2; -1; 0; +1; +2; +3; +4) и высшая (+5) .
Любая молекула является электронейтральной, поэтому алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.
Степень окисления не всегда численно совпадает с валентностно. Например, в N2 (N = N) степень окисления азота равна нулю, а валентность – трем; в H2O2 (H – O – O – H) степень окисления кислорода (-1) , а валентность равна двум.
Дата добавления: 2016-11-22; просмотров: 1948;
