Б) донорно-акценторная связь.
Одним из видов ковалентной связи является донорно-акцепторная (координационная) связь, в которой общую пару электронов полностью представляет один из атомов (донор), а другой атом (акцептор) представляет свободную орбиталь.
 |
 А : + В А : В
А : + В А : В
 |  | ||||
 | |||||
 А + В А В
А + В А В
 Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной электронной парой одного атома (А) и свободной орбитали другого атома (В) . Донорно-акцепторная связь иногда обозначается стрелкой, которая направлена от донора к акцептору : А В
Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной электронной парой одного атома (А) и свободной орбитали другого атома (В) . Донорно-акцепторная связь иногда обозначается стрелкой, которая направлена от донора к акцептору : А В
+
Например: образование иона аммония NH4 :
 NH3 + H + NH4+
NH3 + H + NH4+
Атом азота в молекуле аммиака использует три неспаренных электрона (2p 3) для образования трех связей с атомами водорода; два спаренных электрона (неподеленная пара) внешнего слоя (2s2) в образовании этих связей не участвует. Ион водорода имеет свободную 1s – орбиталь. В результате перекрывания орбитали с неподеленной парой электронов атомы азота и свободной орбитали иона водорода образуется донорно-акцепторная связь:
 H H +
H H +
. . + . .

 H : N : + H H : N : H
H : N : + H H : N : H
. . . .
H 1s H
 |
 H H +
H H +
 +
+






 H N + H H N H
H N + H H N H
H 1s H
 донор акцептор
донор акцептор
+
Заряд иона водорода становиться общим зарядом иона аммония (NH 4). Свойства донорно-акцепторной связи не отличается от свойств обычной ковалентной связи.
В) Ионная связь.
Элементы I и II группы П.С. непосредственно соединяются с элементами V- VIII групп. При этом атомы металлов полностью теряют свои электроны.
Теорию ионной связи предложил в 1916 году немецкий ученый В. Коссель. Данная теория объясняет образование связей между атомами типичных металлов и атомами неметаллов: NaCL, KF, Na2O …
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, превращаясь в положительно заряженные частицы – катионы; атомы типичных неметаллов принимают электроны и превращаются в отрицательные анионы. Заряд катиона равен числу отданных электронов; заряд аниона – числу принятых электронов.
Например:
 Ca - 2 e Ca +2 (ион кальция)
Ca - 2 e Ca +2 (ион кальция)
1s22s22p63s23p64s2 1s22s22p63s23p6
2 e 8 e
_
 O 0 + 2 e O -2 (оксид ион)
O 0 + 2 e O -2 (оксид ион)
1s22s22p4 1s22s22p6
6 e 8 е
Образующиеся ионы имеют завершенные электронные структуры (завершенный электронный октет).
В результате электростатического притяжения между катионом и анионом образуется молекула.
 |  | 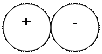 |
 +
+
катион анион молекула
Рассмотрим образование молекулы NaCL.
Последний электрон в атоме натрия (на М – слое) связан не очень сильно. В то же время атом хлора имеет на М – слое семь электронов и до завершения внешнего слоя к нему можно добавить еще один электрон. Если атом натрия и атом хлора близко подходят друг к другу, последний электрон натрия может перейти к атому хлора, в результате образуется молекула хлорида натрия, состоящая из положительного иона натрия и отрицательного иона хлора.
Na 0 + CL Na+1CL-1
атом атом молекула
 K L M K L M
K L M K L M
 |  |  | |||||
 |
2 8 1 2 8 7
_
Na 0 – 1e Na + 1 образование ионов
_
 CL 0 + 1e CL -1
CL 0 + 1e CL -1

 Na+1 + CL -1 Na+1CL-1 соединение ионов
Na+1 + CL -1 Na+1CL-1 соединение ионов
 Na0 + CL 0 Na+1CL-1
Na0 + CL 0 Na+1CL-1
Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения равна нулю, следовательно , молекула является электронейтральной частицей.
Например:
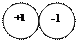 |
Na+1CL-1 +1+ (-1) =0
 |
Ca+2F2-1 +2+ 2(-1) =0
 |
K2+1 O-2 2(+1) + (-2) =0
Резкой границы между ионной и ковалентной полярной связями не существует.
Дата добавления: 2016-11-22; просмотров: 1596;
