Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость(приведите примеры)
Ковалентная связь, атомная связь, гомеополярная связь —химическая связь, образованная пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. Термин ковалентная связь был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году. Этот термин относился к химической связи, обусловленной совместным обладанием электронами, в отличие от металлической связи, в которой электроны были свободными, или от ионной связи, в которой один из атомов отдавал электрон и становился катионом, а другой атом принимал электрон и становился анионом. Ковалентная связь образуется за счет одной или нескольких электронных пар с антипараллельными спинами. Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными . В молекуле фтороводорода НF связь образована 1s-орбиталью атома водорода и 2рх-орбиталью атома фтора: 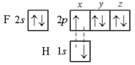 Направленность связи в этой молекуле определяется ориентацией 2рх-орбитали атома фтора (рис. 3). Перекрывание происходит в направлении оси симметрии х. Любой другой вариант перекрывания энергетически менее выгоден.
Направленность связи в этой молекуле определяется ориентацией 2рх-орбитали атома фтора (рис. 3). Перекрывание происходит в направлении оси симметрии х. Любой другой вариант перекрывания энергетически менее выгоден. 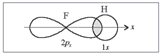
НАСЫЩАЕМОСТЬ — характерное свойство ковалентной связи. Она проявляется в способности атомов образовывать ограниченное число ковалентных связей. Это связано с тем, что одна орбиталь атома может принимать участие в образовании только одной ковалентной химической связи. Данное свойство определяет состав молекулярных химических соединений. Так, при взаимодействии атомов водорода образуется молекула Н2, а не Н3. С точки зрения МВС третий атом водорода не может присоединиться, так как спин его электрона окажется параллельным спину одного из спаренных электронов в молекуле. Способность к образованию того или иного числа ковалентных связей у атомов различных элементов ограничивается получением максимального числа неспаренных валентных электронов.
Дата добавления: 2016-07-09; просмотров: 1691;
