Уравнение Де-Бройля, корпускулярно-волновые свойства микрообъектов(дуализм), принцип неопределенности Гейзенберга
Степень окисления
Степень окисления – это условный заряд атома в молекуле химического соединения,
вычисленный исходя из предположения, что все молекулы химического соединения состоят
из ионов, то есть общие электронные пары переходят к наиболее электроотрицательному
элементу. Степени окисления атомов могут быть положительными, отрицательными или нулевыми (в том случае, когда молекулы вещества состоят из однородных атомов). Очень важное условие: суммарная степень окисления молекулы всегда равна нулю. Следует также знать, что величина степени окисления атома элемента не всегда совпадает с его валентностью. Хороший пример тому – углерод. Можете сами убедиться, вспомнив формулы некоторых органических молекул, у него при одинаковой валентности, равной четырем, могут быть разные степени окисления. Металлы при соединении с неметаллами всегда имеют положительные степени окисления. Неметаллы же, соответственно, отрицательные. Если же соединение состоит из атомов разных неметаллов, то более электроотрицательным (то есть имеющим отрицательную степень окисления) будет тот элемент, который располагается в таблице Менделеева выше и правее. Его высшую отрицательную степень окисления можно найти, вычтя из цифры 8 номер группы, в которой он находится. Второй элемент, соответственно, будет иметь положительную степень окисления, равную номеру уже его группы. Например, оксид азота N2O5. Найдите степени окисления элементов, входящих в его состав, руководствуясь этими правилами. И азот, и кислород – неметаллы. Какой из этих элементов более электроотрицательный? Согласно таблице Менделеева это кислород, поскольку он расположен на одном уровне с азотом, но правее (в шестой группе, а азот – в пятой). Значит, его степень окисления отрицательна и равна -2. Степень окисления азота, таким образом, положительна и равна +5. Проверьте, нейтральна ли эта молекула (с учетом индексов). Суммарный заряд атомов азота +10. Суммарный заряд атомов кислорода – 10. Условие соблюдено.
«Классы и номенклатура неорганических соединений»
Важнейшими классами неорганических соединений являются оксиды, кислоты, основания и соли. 1)Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления (– 2). При написании формулы оксида символ элемента, образующего оксид, ставится на первое место, а кислорода – на второе. Общая формула оксидов: ЭхОу. В случае, когда элемент обладает переменной степенью окисления и образует несколько оксидов, после названия этого элемента указывают его степень окисления римской цифрой в скобках, или прибегают к помощи греческих числительных (1-моно, 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса, 7-гепта, 8-окта). Например, VO – оксид ванадия (II) или монооксид ванадия; Особую группу кислородных соединений элементов составляют пероксиды. Обычно их рассматривают как соли пероксида водорода Н2О2, проявляющего слабые кислотные свойства. У пероксидов атомы кислорода химически связаны не только с атомами других элементов, но и между собой (образуют пероксидную группу –О–О–). Например, пероксид натрия Na2O2 (Na–O–O–Na), а оксид натрия Na2O (Na–O–Na). В пероксидах степень окисления кислорода равна (–1). Так, в пероксиде бария BaO2 степень окисления бария равна +2, а кислорода –1.
2) Основания – это электролиты, диссоцирующие в водном растворе с образованием катиона металла (или иона аммония NH4+) и гидроксогруппы ОН–.Названия оснований Общая формула оснований: Мe(ОН)n. Согласно международной номенклатуре названия оснований составляются из слова гидроксид и названия металла. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция. Если элемент образует несколько оснований, то в названии указывается степень его окисления римской цифрой в скобках: Fe(OH)2 – гидроксид железа (II),Fe(OH)3 – гидроксид железа (III).Помимо этих названий для некоторых наиболее важных оснований применяются и другие, в основном традиционные русские названия. Например, гидроксид натрия NaOH называют едким натром, гидроксид кальция Ca(OH)2 – гашеной известью, КОН – едким кали. Число ОН– -групп, содержащихся в молекуле основания, определяет его кислотность. По этому признаку основания делятся на одно кислотные (КОН), двух кислотные (Cu(OH)2), трех кислотные(Cr(OH)3).Гидроксиды, растворимые в воде, называют щелочами. Это гидроксиды щелочных и щелочно-земельных металлов: NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2.
3) Кислоты – это электролиты, диссоцирующие в водном растворе с образованием катиона водорода Н+ и аниона кислотного остатка .Названия кислот В общем виде формула кислоты записывается как НmЭ или НmЭОn, где Э –кислотообразующий элемент. По химическому составу, а именно по отсутствию или наличию атомов кислорода вмолекулах, кислоты делятся на кислородосодержашие (H2SO4, HNO3) и бескислородные (H2S, HF, HCl).Кислоты имеют традиционные и систематические названия, составляемые по номенклатурным правилам ИЮПАК для сложных соединений. Традиционное название кислоты складывается из двух слов. Первое слово – прилагательное с корнем от русского названия кислотообразующего элемента, второе – слово «кислота», например, серная кислота, азотная кислота. В названиях кислородосодержащих кислот для обозначения степени окисления кислотообразующего элемента используются следующие суффиксы:–н, –ов, –ев – (высшая или любая единственная степень окисления), как HClO4 – хлорная,H2SO4 – серная, HMnO4 – марганцовая кислота; H2SiO3 – метакремниевая кислота.–новат – (промежуточная степень окисления +5), как HClO3 – хлорноватая, HIO3 – йодноватая,H2MnO4 – марганцоватая кислота.–овист, –ист – (промежуточная степень окисления +3, +4), как H3AsO3 – ортомышьяковистая кислота; HClO2 – хлористая; HNO2 – азотистая.–новатист – (низшая положительная степень +1), как HClO – хлорноватистая. Если элемент в одной и той же степени окисления образует несколько кислородосодержащихкислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляют префикс «мета», при наибольшем числе – префикс «орто»: НРО3 – метафосфорная кислота, Н3РО4 –ортофосфорная кислота (степень окисления фосфора равна +5).Названия бескислородных кислот производятся от названия неметалла с окончанием «о» и прибавлением слова водородная: HF – фтороводородная или плавиковая кислота HCl – хлороводородная или соляная кислота
4) Соли – это электролиты, диссоцирующие в водном растворе с образованием катионов основных остатков и анионов кислотных остатков. Формулы и названия солей Состав соли описывается формулой, в которой на первое место ставится формула катиона, а на второе – формула аниона. Названия солей образуются от названия кислотного остатка (в именительном падеже) и названия основного остатка (в родительном падеже), входящих в состав соли. Степень окисления металла, образующего катион, указывается римскими цифрами в скобках, если это необходимо. Например, K2S – сульфид калия, FeSO4 – сульфат железа (II),Fe2(SO4)3 – сульфат железа (III).Анион бескислородной кислоты имеет окончание «ид». Например, FeCl3 – хлорид железа (III).Названия кислых солей образуются также, как и средних, но при этом к названию аниона добавляют приставку «гидро», указывающую на наличие атомов водорода, число которых обозначается греческими числительными: ди, три и.т.д. Например: Fe(HSO4)3 – гидросульфат железа (III), NaH2PO4 – дигидрофосфат натрия. Названия основных солей образуются также, как и средних, но при этом к названию катиона добавляют приставку «гидроксо», указывающую на наличие гидроксо групп, число которых обозначается греческими числительными: ди, три и.т.д. Например: (CuOH)2CO3 – карбонат гидроксомеди (II), Fe(OH)2Cl – хлорид дигидроксо железа (III).
Планетарная модель атома Резерфорда.
Планетарная модель атома, или модель Резерфорда — историческая модель строения атома, которую предложил Эрнест Резерфорд в результате эксперимента с рассеиванием альфа-частиц. По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны, — подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики. Рассеяние -частиц при прохождении через фольгу вызывается кулоновскими силами, т.е. электрическим взаимодействием частицы и заряда атома. Гравитационное взаимодействие в 10 33 раз меньше, поэтому фактически роли не играет. Электроны не могут этого сделать, так как их масса много меньше массы частицы: m=7350me.При взаимодействии с электронами быстро движущаяся частица не изменяет направление своего движения. Причиной рассеяния частицы является их взаимодействие с положительно заряженными частицами атома, занимающими очень малую область атома. Резерфорд назвал эту область ядром. В ядре сосредоточена почти вся масса атома и весь положительный заряд. Обобщив результаты опытов, Резерфорд предложил следующую модель строения атома:1. в центре атома - положительно заряженное ядро: заряд ядра q = Z·e, где Z-порядковый номер элемента в таблице Менделеева, e =1.6·10-19 Кл - элементарный заряд; размер ядра 10-13 см; масса ядра фактически равна массе атома. 2. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца: электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение. число электронов в атоме равно Z ( порядковый номер элемента), электроны движутся с большой скоростью, образуя электронную оболочку атома.
Постулаты Бора
В 1913 году Бор показал, что несовпадение с экспериментом выводов, основанных на модели Резерфорда, возникла потому, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел. Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения. Законы микромира - квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и "спасающих") атом Резерфорда. Первый постулат: Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1, Е2...En. Находясь в стационарном состоянии, атом энергии не излучается несмотря на движение электронов. Второй постулат: В стационарном состоянии атома электроны движутся по стационарным орбитам, для которых выполняется квантовое соотношение: m·V·r = n·h/2· (1)где m·V·r =L - момент импульса, n=1,2,3..., h-постоянная Планка. Третий постулат: Излучение или поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое. При этом излучается или поглощается порция энергии (квант), равная разности энергий стационарных состояний, между которыми происходит: = h·= Em-En (2)
Уравнение Де-Бройля, корпускулярно-волновые свойства микрообъектов(дуализм), принцип неопределенности Гейзенберга
В 1924 году французский физик Луи де Бройль высказал гипотезу о том, что установленный ранее[1] для фотонов корпускулярно-волновой дуализм присущ всем частицам — электронам, протонам, атомам и так далее, причём количественные соотношения между волновыми и корпускулярными свойствами частиц те же, что и для фотонов. Таким образом, если частица имеет энергию 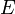 и импульс, абсолютное значение которого равно
и импульс, абсолютное значение которого равно 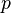 , то с ней связана волна, частота которой
, то с ней связана волна, частота которой 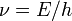 и длина волны
и длина волны 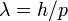 , где
, где 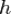 — постоянная Планка. Эти волны и получили название волн де Бройля. Для частиц не очень высокой энергии, движущихся со скоростью
— постоянная Планка. Эти волны и получили название волн де Бройля. Для частиц не очень высокой энергии, движущихся со скоростью  (скорости света), импульс равен
(скорости света), импульс равен 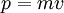 (где
(где 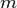 — масса частицы), и
— масса частицы), и 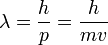 . Следовательно, длина волны де Бройля тем меньше, чем больше масса частицы и её скорость. Например, частице с массой в 1 г, движущейся со скоростью 1 м/с, соответствует волна де Бройля с
. Следовательно, длина волны де Бройля тем меньше, чем больше масса частицы и её скорость. Например, частице с массой в 1 г, движущейся со скоростью 1 м/с, соответствует волна де Бройля с 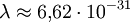 м, что лежит за пределами доступной наблюдению области. Поэтому волновые свойства несущественны в механике макроскопических тел. Для электронов с энергиями от 1 эВ до 10 000 эВ длина волны де Бройля лежит в пределах от ~ 1 нм до 10−2 нм, то есть в интервале длин волн рентгеновского излучения. Поэтому волновые свойства электронов должны проявляться, например, при их рассеянии на тех же кристаллах, на которых наблюдается дифракция рентгеновских лучей. Первое подтверждение гипотезы де Бройля было получено в 1927 году в опытах американских физиков К. Дэвиссона и Л. Джермера. Пучок электронов ускорялся в электрическом поле с разностью потенциалов 100—150 В (энергия таких электронов 100—150 эВ, что соответствует
м, что лежит за пределами доступной наблюдению области. Поэтому волновые свойства несущественны в механике макроскопических тел. Для электронов с энергиями от 1 эВ до 10 000 эВ длина волны де Бройля лежит в пределах от ~ 1 нм до 10−2 нм, то есть в интервале длин волн рентгеновского излучения. Поэтому волновые свойства электронов должны проявляться, например, при их рассеянии на тех же кристаллах, на которых наблюдается дифракция рентгеновских лучей. Первое подтверждение гипотезы де Бройля было получено в 1927 году в опытах американских физиков К. Дэвиссона и Л. Джермера. Пучок электронов ускорялся в электрическом поле с разностью потенциалов 100—150 В (энергия таких электронов 100—150 эВ, что соответствует 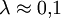 нм) и падал на кристалл никеля, играющий роль пространственной дифракционной решётки. Было установлено, что электроны дифрагируют на кристалле, причём именно так, как должно быть для волн, длина которых определяется соотношением де Бройля.
нм) и падал на кристалл никеля, играющий роль пространственной дифракционной решётки. Было установлено, что электроны дифрагируют на кристалле, причём именно так, как должно быть для волн, длина которых определяется соотношением де Бройля.
Принцип неопределенности Гейзенберга заключается в том, что в 1926 г. В.Гейзенберг разрабатывает свой вариант квантовой теории в виде матричной механики, отталкиваясь при этом от принципа соответствия. В своем принципе неопределенности Гейзенберг строил матричную теорию, все величины которой должны описывать лишь наблюдаемые явления. И хотя наличие в аппарате его теории матриц, изображающих координаты и импульсы электронов в атомах, оставляет сомнение в полном исключении ненаблюдаемых величин, Гейзенберту удалось создать новую квантовую концепцию, составившую новую ступень в развитии квантовой теории. Суть принципа неопределенности Гейзенберга состоит в замене физических величин, имеющих место в атомной теории, матрицам - таблицам чисел. Результаты, к которым приводили методы, используемые в волновой и матричной механике, оказались одинаковыми, поэтому обе концепции и входят в единую квантовую теорию как эквивалентные. Методы матричной механики, в силу своей большей компактности часто быстрее приводят к нужным результатам. Методы волновой механики, как считается, лучше согласуется с образом мышления физиков и их интуицией. Большинство физиков при расчетах пользуется волновым методом и использует волновые функции. Гейзенберг сформулировал принцип неопределенности, в соответствии с которым координаты и импульс не могут одновременно принимать точные значения. Для предсказания положения и скорости частицы важно иметь возможность точно измерять ее положение и скорость. При этом чем точнее измеряется положение частицы (ее координаты), тем менее точными оказываются измерения скорости.
Дата добавления: 2016-07-09; просмотров: 1924;
