Понятие о гибридизации атомных орбиталей и его применение для описания конфигурации молекул и ионов. Приведите примеры соединений.
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ - выравнивание длин хим. связей и валентных углов при образовании хим. связей валентными s-, p-, d- и т.д. электронами (атомными орбиталями) одного атома. Г. а. о. описывает возбуждённые состояния атома в хим. соединении. С помощью методов рентг. структурного анализа, спектральных измерений и т. п. установлено, что хим. связи, образуемые электронами атома, находящимися в разл. квантовых состояниях, эквивалентны, вопреки казалось бы очевидному предположению о их различии (так, напр., р-электроны должны были бы создавать более прочную связь, чем s-электроны). Выравнивание связей является результатом смешивания при хим. взаимодействии состояний электронов в атоме, что приводит к образованию гибридных орбиталей, направленных в сторону образующейся связи .Гибридные ф-ции, соответствующие новым орбиталям, являются линейными комбинациями s-, p-, d- и т. д. атомных одноэлектронных При гибридизации атомных орбиталей электронные облака концентрируются в направлении линии связи (оси x).
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[3].
| Тип гибридизации | Число гибридных орбиталей | Геометрия | Структура | Примеры |
| sp | Линейная | 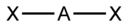
| BeF2, CO2, NO2+ | |
| sp2 | Треугольная | 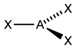
| BF3, NO3-, CO32- | |
| sp3 | Тетраэдрическая | 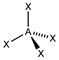
| CH4, ClO4-, SO42-, NH4+ | |
| dsp2 | Плоскоквадратная | 
| Ni(CO)4, XeF4 | |
| sp3d | Гексаэдрическая | 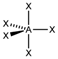
| PCl5, AsF5 | |
| sp3d2 | Октаэдрическая | 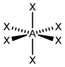
| SF6, Fe(CN)63-, CoF63- |
В качестве примера рассмотрим молекулы NH3 и H2O. Атомы азота и кислорода склонны к sp3-гибридизации. У азота на sp3-ГО, поимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая пара. Именно она, занимая одну sp3-ГО, искажает угол связи H√N√H до 107,3╟. В молекуле H2O таких несвязывающих пар две, и угол H√O√H равен 104,5
Дата добавления: 2016-07-09; просмотров: 1291;
