Г) Металлическая связь.
Элементы, атомы которых легко теряют электроны, образуют металлическую связь. Таким свойством обладают металлы, имеющие на внешнем электронном слое небольшое число электронов (от 1 до 3); эти электроны валентные и прочность связи валентных электронов с ядром невысокая, т.е. атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов и превращения атомов металла в положительно заряженные ионы (катионы):
_
 Me0 - ne Me n+
Me0 - ne Me n+
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами.
Схема кристаллической решетки металлов.
 |  |  |  |
  . .
|  .
. .
.
|  .
.
|
  .
. .
.
|  .
.
|  . .
|
  .
.
|  .
. .
.
|  .
. .
.
|
В углах кристаллической решетки находятся ионы металлов (M e n+1), между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла.
Химическая связь между атомами и ионами металлов, основанная на обобществлении валентных электронов получила название металлической.
Металлическая связь довольна прочная, особенно у тяжелых металлов, чем и объясняется определенный комплекс физических и химических свойств металлов. Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов, то есть способность подвергаться разнообразной обработке без разрушения; свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Строением кристаллической решетки металла объясняется также способность отражать световые волны, то есть металлический блеск.
Металлическая связь проявляется в твердом и жидком состоянии металла, тогда как в газообразном состоянии молекулы металла представляют собой отдельные атомы, почти не действующие друг на друга.
Однако и у неметаллов при определенных условиях, например, у фосфора при сверхвысоком давлении, атомная связь переходит в металлическую; у металла висмута в твердом состоянии наряду с металлической имеется атомная связь.
д) Водородная связь.
Ионная, ковалентная, металлическая, химические связи являются только внутримолекулярными, но особый вид межмолекулярного и внутримолекулярного взаимодействия представляет водородная связь. Примером внутримолекулярной водородной связи может быть водородная связь в двухосновной кислоте:
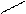 О
О
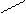

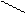
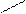 С
С

 О-δ H +δ
О-δ H +δ

 О-δ H
О-δ H

 С
С
О
Примером межмолекулярной связи может быть водородная связь между молекулами воды:

 H +δ О –δ …H +δ О –δ
H +δ О –δ …H +δ О –δ


H +δ H+δ
Водородная связь образуется между атомом водорода, связанным с сильным электроотрицательным элементом и другим сильным электроотрицательным элементом.
Водородная связь может рассматриваться как некоторая дополнительная связь, которую проявляет атом водорода, уже связанный в молекуле ковалентной связью с другим атомом.
Атом водорода образует водородную связь лишь с атомами определенных элементов, к которым относятся атомы F, CL, O, S, N (фтора, хлора, кислорода, серы, азота). Эти атомы сильно стягивают на себя общую электронную пару, что вызывает появление у них эффективного отрицательного заряда и приводит к превращению атома водорода в протон, почти лишенный электрона.
В отличии от других положительных ионов положительный ион водорода не имеет электронов, поэтому не отталкивается электронными облаками названных выше отрицательно заряженных атомов, а только притягиваются. Так как размеры протона во много раз меньше размеров других ионов, то это позволяет ему ближе подходить к другим частицам. Водородная связь и является причинной ассоциации молекул некоторых водородных соединений. Например, во фтороводороде существуют не только молекулы HF, но и ассоциирование агрегаты (HF)2 и (HF) 3
 F- F -
F- F -
. .
. H+ . H +
. . .
. . .

 H+ . H +
H+ . H +
.
F - F –
В обычной воде за счет водородной связи существуют ассоциированные молекулы состава (H2O)n, где n=2,3,4,5…; простые молекулы воды существуют в парообразном состоянии:
O . . . H H O
 |  |  | 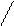 | 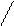 | 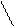 |
. . H H O . . . . .H H
Именно наличием водородных связей объясняется повышением температуры кипения (1000 С) по сравнению с водородными соединениями элементов подгруппы кислорода (H2S, H2Se, H2Te) а также ее жидкое и твердое агрегатные состояния при незначительной молекулярной массе.
Существование ассоциатов у воды и является причиной различных аномалий воды.
Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений. Водородную связь могут иметь разнородные молекулы, например, воды и спирта:
 С2H5 O . . . . H H .
С2H5 O . . . . H H .
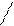
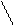
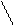 .
.
H . . . O .
Водородные связи обозначают пунктирной линией или точками и этим указывают, что она намного слабее ковалентной связи (примерно в 15-20 раз).
Итак, водородная связь – это химическая связь, образованная атомом водорода, связанного с атомом другого элемента, который обладает большим значением электроотрицательности.
Дата добавления: 2016-11-22; просмотров: 1773;
