А) ковалентная связь
В 1916 г. американский ученый Г. Льюис разработал теорию ковалентной химической связи.
Он так же, как и В. Коссель, исходил из положения, что атомы стремятся иметь восьмиэлектронный слой: электронный октет или электронный дуплет. Ковалентная связь существует в молекулах простых веществ (H2 , CL2 , O2 , N2 и др.) и в молекулах, которые образованы атомами различных неметаллов (HCL, H2O , PCL3, NH3, CO и др.)
Согласно теории Г. Льюиса, образование устойчивой электронной конфигурации происходит путем обобщения электронов с образованием пары, общей для обоих атомов.
Квантово-механическая теория электронного строения атомов объясняет образование общей электронной пары как перекрывание электронных облаков. В перекрывании могут участвовать электронные облака неспаренных электронов, которые имеют антипараллельные спины.
Например, при столкновении друг с другом атомов водорода, электроны, ранее принадлежвщие двум разным ядрам, обобществляются, образуя единое электронное облако:
Схема перекрывания электронных облаков в молекуле водорода H2
 H . + . H H (:) H
H . + . H H (:) H
1s
| |  | |||
 + H 2
+ H 2
 | |||||
 | |||||
 |
1 s



 z z
z z
 |  | ||||
 | |||||





 х + х
х + х
 | |||||||
 |  |  | |||||

 1s1 1s1
1s1 1s1
Двухэлектронная связь, принадлежащая одновременно двум ядрам, называется ковалентной связью.
Условно она обозначается черточками (F – F ; О = О) .
При образовании молекулы из одинаковых атомов плотность электронного облака оказывается симметрична относительно ядер обоих атомов. Такая ковалентная связь называется неполярной или гомеополярной, т.е. это ковалентная связь между атомами с одинаковой электроотрицательностью.
Если молекула образована различными атомами, то молекулярное электронное облако смещается в сторону атома, имеющего наибольшую электроотрицательность. Такая ковалентная связь называется полярной или гетерополярной.
Например: в молекуле хлороводорода HCL общая электронная пара (т.е. область перекрывания электронных облаков) смещается в сторону атома хлора, потому что он является более электроотрицательным:
. . . .


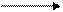 H . + .CL : H : CL :
H . + .CL : H : CL :
. . . .
ЭО 2,1 3,0
 |
В результате у атома хлора возникает некоторый избыточный отрицательный заряд ( - δ ), а у атома водорода – заряд, равный по величине, но противоположный по знаку ( + δ ) . Чем больше полярность связи, тем больше абсолютная величина этих зарядов.
Полярность молекулы определяется полярностью связей в этой молекуле и их взаимным расположением. Например, в молекуле HCL существует только одна полярная связь. Эта молекула является полярной молекулой; в ней есть центр положительного заряда (на атоме водорода) и центр отрицательного заряда (на атоме хлора).
+ δ - δ
HCL
Полярные молекулы являются диполями. Диполь (два полюса) – это система, в которой имеются центры положительного и отрицательного зарядов, расположенных на определенном расстоянии друг от друга.
В зависимости от того, какие именно электроны – s, p или d обобществляются, возможны различные типы ковалентной связи. Два s – элемента могут образовать только такую связь, при которой перекрывание электронных облаков происходит вдоль прямой, соединяющей центры взаимодействующих атомов. Такую связь называют сигма - связью (σ – сигма).
S S




Сигма – связь может возникать и при взаимодействии одного S – электрона и одного p – электрона, а также при сближении двух p - электронов.




 S P P P
S P P P
 | |||
 |
Сигма – связь является примером одинарной (простой) связи. Одинарные (простые связи) – это ковалентные связи, которые образованы одной общей электронной парой.
Но два p – электрона наряду с σ – связью могут образовать еще один тип связи, при котором перекрывание электронных облаков проходит к оси связи двух атомов.
P P
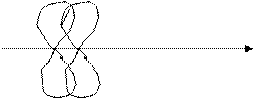 |
Этот тип называется π – связью (пи – связь).
π - связи - это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.
Перекрывание p – орбитали при образовании π – связей происходит вне области максимальных плотностей электронных облаков, поэтому прочность π - связи меньше прочности σ – связи.
В образовании π - связи могут участвовать и d –электроны.
Ковалентные связи бывают одинарными (связь между двумя атомами образована одной общей электронной парой); двойными (связь между двумя атомами образована двумя общими электронными парами); тройными (связь между двумя атомами образована тремя общими электронными парами).
Двойные и тройные связи называются кратными связями. Двойная связь состоит из одной σ – связи и двух π – связей.
Пример: Образование кратной (тройной) связи на примере образования молекулы азота (N 2).
Структура внешнего электронного слоя атома азота: 2s2 2p3; на внешнем слое находится 5 электронов, p – электроны являются неспаренными. p – электроны обоих атомов участвуют в образовании трех общих электронных пар.

 . . . . .
. . . . .
 : N . + . N : : N : : N : N ≡ N
: N . + . N : : N : : N : N ≡ N
. .
Схема перекрывание электронных облаков в молекуле азота.




 z z z π z
z z z π z
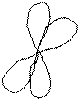 |  |  | |||







x x x
 |
π
y y y y
Дата добавления: 2016-11-22; просмотров: 2907;
