Магнитное квантовое число.
Орбитали одного подуровня отличаются направлением (ориентацией) в пространстве.
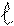
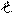 Магнитное квантовое число «m » уточняет энергию электрона на подуровне, характеризует расположение орбитали в пространстве.
Магнитное квантовое число «m » уточняет энергию электрона на подуровне, характеризует расположение орбитали в пространстве.
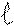 Магнитное квантовое число принимает значения целых чисел от (- ) через 0 до (+ ) .
Магнитное квантовое число принимает значения целых чисел от (- ) через 0 до (+ ) .
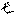 Число значений m определяет число орбиталей на подуровне:
Число значений m определяет число орбиталей на подуровне:
 |

 S – подуровень: = 0; m = 0 1 орбиталь
S – подуровень: = 0; m = 0 1 орбиталь
 Z
Z
 Форма и направление
Форма и направление




 S – электронной орбитали
S – электронной орбитали
Х
Y
 |


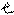 P –подуровень: = 1; m = - 1 , 0, + 1 3 орбитали
P –подуровень: = 1; m = - 1 , 0, + 1 3 орбитали
 Все три p – орбитали взаимно перпендикулярны, направлены вдоль осей пространственных координат и их обозначение px, py, pz
Все три p – орбитали взаимно перпендикулярны, направлены вдоль осей пространственных координат и их обозначение px, py, pz




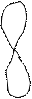

 z z z
z z z
Форма и направления


 р – электронных орбиталей х х х
р – электронных орбиталей х х х
y y y
Pх Py Pz
 Графически m изображается в виде квадратика, называется магнитной квантовой ячейкой, одну ячейку максимально могут занимать 2 электрона.
Графически m изображается в виде квадратика, называется магнитной квантовой ячейкой, одну ячейку максимально могут занимать 2 электрона.
Число ячеек на подуровнях
|
|
|
|
|
|
|
|
|
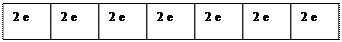 |
f 14 - семь
Энергетическая ячейка на конкретном уровне и подуровне - это и есть электронная орбиталь. Таким образом электронную орбиталь характеризуют три квантовых числа: главное (размер большой полуоси орбитали), орбитальное (форму орбитали) и магнитное (расположение орбитали в пространстве).
Два электрона, расположение в одной ячейке, имеют разное спиновое квантовое число.
Спиновое квантовое число (m s )
 Спиновое квантовое число характеризует движение электрона (вращение) вокруг собственной оси, не связанное с его движением вокруг ядра. Спиновое квантовое число принимает значения:
Спиновое квантовое число характеризует движение электрона (вращение) вокруг собственной оси, не связанное с его движением вокруг ядра. Спиновое квантовое число принимает значения:
+ 1 и - 1 и в электронографических формулах обозначается
2 2
Схематическое изображение вращения электрона:


 электрон
электрон



 электрон
электрон



ось вращения ось вращения
 | |||
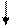 | |||
m = + 1 ( ) m = - 1 ( )
2 2
Пример: Распределить электроны атома серы по уровням, подуровням, квантовым ячейкам:
16S K L M
n=1 n=2 n=3 (по уровням)
2 8 6
1s2 2s22p6 3s23p43d (по подуровням)
s p
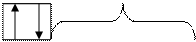 |
n=1 d по магнитным
квантовым ячейкам 














| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
n=2
n=3
Электроны заполняют энергетические уровни и подуровни в соответствии с принципом минимальной энергии, принципом Паули, правилом Гунда.
Принцип минимальной энергии – электрон занимает положение на уровне и подуровне с минимальным запасом энергии.
Принцип Паули – в атоме не может быть даже двух электронов с одинаковыми значениями всех четырех квантовых чисел.
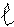
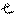

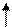
| |
Правило Гунда - орбитали подуровня заполняются электронами таким образом, чтобы суммарное спиновое число было максимально, т.е. квантовые ячейки одного подуровня заполняются сначала по одному электрону, а затем по второму с противоположно направленным спином.
 |
Пример: p 4 - верно
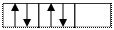 |
P4 - неверно
Электронная формула элемента – это распределение электронов в атоме по уровням, подуровням, орбиталям (квантовые ячейки). Электронная формула дает представление об энергии электронов и их орбиталях.
17CL K L M
n=1 n=2 n=3
2 8 7 (по уровням)

 1s2 2s22p6 3s23p53d (по подуровням)
1s2 2s22p6 3s23p53d (по подуровням)
|
|
По квантовым ячейкам целесообразно расписывать только те уровни, на которых находится валентные электроны. У хлора 7 валентных электрона, которые находятся на последнем уровне.
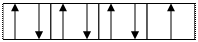 |
n= 3
 |
s p
_ _
6 е спаренных , 1 е неспаренный
Валентные электроны принимают участие в образовании химической связи. Это наиболее удаленные от ядра электроны, наиболее подвижные. Для элементов главных подгрупп – последнего уровня, а для элементов побочных подгрупп – последнего и предпоследнего уровней. Количество валентных электронов у атомов определяется номером группы, в которой находится элемент.
Пример: 6С n=1 n=2
2 4
1s2 2s22p2
Валентные электроны, находящиеся на последнем уровне.
Дата добавления: 2016-11-22; просмотров: 2469;
