Виды химической связи: ионная, металлическая, ковалентная (полярная, неполярная), водородная.
Различают четыре основных вида химической связи:
1. Ковалентная связь осуществляется общими электронными парами. Она образуется в результате перекрывания электронных облаков (орбиталей) атомов неметаллов. Чем больше перекрывание электронных облаков, тем прочнее химическая связь. Ковалентная связь бывает полярная и неполярная. Ковалентная неполярная связь возникает между атомами одного вида, у которых электроотрицательность одинакова. (Электроотрицательность – это свойство атомов притягивать к себе электроны). Например, образование молекулы водорода можно показать схемой:
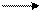 H . + .H = H (:) H H2
H . + .H = H (:) H H2
или H . + .H = H – H
Аналогично образуются молекулы O2, Cl2, N2, F2 и др.
Неполярная ковалентная связь симметрична. Электронное облако, образованное общей (поделенной) электронной парой, одинаково принадлежит двум атомам.
Полярная ковалентная связь возникает между атомами, электроотрицательности которых отличаются, но незначительно. В этом случае общая электронная пара сдвигается в сторону более электроотрицательного элемента, например, при образовании молекулы хлороводорода электронное облако связи смещено к атому хлора. За счет этого смещения атом хлора приобретает частичный отрицательный заряд, а атом водорода – частичный положительный заряд, а образующаяся молекула является полярной.
H + Cl = H Cl H → Cl HCl
Аналогично образуются молекулы HBr, HI, HF, H2O, CH4 и т.д.
Ковалентные связи бывают одинарные (осуществляются одной общей электронной парой), двойные (осущ. двумя общими электронными парами), тройные (осущ. тремя общими электронными парами). Например, в этане все связи одинарные, в этилене присутствует двойная связь, а в ацетилене – тройная связь.
Этан: CH3 –CH3 Этилен: CH2 = CH2 Ацетилен: CH ≡ CH
2. Ионная связь возникает в соединениях, образуемых атомами элементов, которые сильно отличаются по электроотрицательности, т. е. с резко противоположными свойствами (атомы металлов и неметаллов). Ионы – это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Ионная связь образуется за счет электростатического притяжения разноименно заряженных ионов. Например, атом натрия, отдавая свой электрон, превращается в положительно заряженный ион, а атом хлора, принимая этот электрон, превращается в отрицательно заряженный ион. За счет электростатического притяжения между ионами натрия и хлора возникает ионная связь:
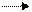
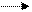 Na + Cl Na+ + Cl– Na+Cl–
Na + Cl Na+ + Cl– Na+Cl–
Молекулы хлорида натрия существуют только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют.
Ионную связь можно рассматривать как крайний случай ковалентной связи.
3. Металлическая связь существует в металлах и сплавах. Она осуществляется за счет притяжения между ионами металла и обобществленными электронами (это валентные электроны, которые покинули свои орбитали и перемещаются по всему куску металла между ионами – « электронный газ »).
4. Водородная связь – это своеобразная связь, которая возникает между атомом водорода одной молекулы, имеющим частичный положитедьный заряд, и электроотрицательным атомом другой или той же самой молекулы. Водородная связь может быть межмолекулярной и внутримолекулярной. HF…HF…HF.Обозначается точками. Слабее ковалентной.
| <== предыдущая лекция | | | следующая лекция ==> |
| Катализатор в химической реакции не расходуется и в конечные продукты не входит. | | | Обратимость химических . реакций. Химическое равновесие и условия его смещения, практическое применение. |
Дата добавления: 2016-05-05; просмотров: 32833;
