Классификация, состав, номенклатура оксидов, кислот, оснований. Способы получения и их химические свойства. 2 страница
hv
Н2 + С12 = 2НС1
t
Н2 + S = H2S
или выделяют из соответствующих солей:
t
2NaCl (тв.) + H2SO4(конц.) = 2НС1↑ + Na2SO4

FeS (тв.) + H2SO4 (разб.) = H2S + FeSO4
Кислородсодержащие кислоты получают различными способами. Конечнойстадией многих способов является растворение кислотных оксидов в воде:
SO3 + H2O = H2SO4
Р2O5 + ЗН3O= 2Н3РO4
4NO2 + O2 + 2Н2O = 4HNO3
Слабые кислородсодержащие кислоты выделяются из их солей при действии более сильных кислот:
Na2SiO3 + 2HC1 = H2SiO3↓ + 2NaCl
Ca3(PO4)2 + 3H2SO4 = 2Н3РO4 + 3CaSO4
Некоторые кислотосодержащие кислоты получают окислением простых веществ-неметаллов:
О +5
3Р + 5HNO3 (разб.) + 2Н2O = 3Н3РO4 + 5NO↑
о +6
S + 2HNO3 (разб.) = H2SO4 + 2NO↑
Вопросы для самоподготовки:
1. Несолеобразующие оксиды. Приведите примеры.
2. Солеобразующие оксиды. Приведите примеры.
3. С помощью уровнений реакций охарактеризуйте химические свойства оксида меди (II), оксида серы (IV), оксида цинка.
4. На какие группы делятся основания по растворимости в воде? Приведите примеры.
5. Напишите уравнения реакции нейтрализации в молекулярной и ионной форме.
6. Номенклатура и классификация кислот.
7. Охарактеризовать химические свойства кислот.
8. Написать уравнения диссоциации многоосновной кислоты (H3PO4).
9. Осущесвите цепочку превращений:
Кислота + нормальная соль → новая нормальная соль + новая кислота
Кислота + нормальная соль → кислая соль
Кислота + основная соль → нормальная соль + вода
Кислота + металл → соль + разные продукты реакции
Лекция № 7.
Тема: Классификация, состав, номенклатура солей. Способы получения и их
химические свойства.
План
1. Классификация солей.
2. Электролитическая диссоциация. Номенклатура.
3. Физические свойства.
4. Химические свойства:
а) реакции ионного обмена;
б) окислительно-восстановительные реакции;
в) реакции разложения солей, происходящие без переноса электронов.
5. Способы получения.
|
|
| Соли |

| Двойные KCl·NaCl, K2SO4·Al2(SO4)3 или KAI(SO4)2 | |
| Основные. CuOHBr, Fe(OH)2NO3, (NiOH)2SO4 |
| Комплексные [Ag(NH3)2]Cl, K3[Fe(CN)6] |

2. Электролитическая диссоциация. Номенклатура. Нормальные (средние) соли.
Практически все соли являются сильными электролитами, т.е. в водных растворах полностью диссоциируют на ионы. Характер диссоциации зависит от типа соли.
 NaCl Na+ + С l - хлорид натрия
NaCl Na+ + С l - хлорид натрия
 A12(SO4)3 2А1 + 3SO4 2- сульфат алюминия
A12(SO4)3 2А1 + 3SO4 2- сульфат алюминия
NH4NO3 NH4+ + NO3 - нитрат аммония
Кислые соли:
 КНСО3 К+ + НСО3- гидрокарбонат калия
КНСО3 К+ + НСО3- гидрокарбонат калия
 Са(Н2РO4)2 Са2+ + 2Н2РO4 - дигидрофосфат кальция
Са(Н2РO4)2 Са2+ + 2Н2РO4 - дигидрофосфат кальция
 NH4HS NH4+ + HS- гидросульфид аммония
NH4HS NH4+ + HS- гидросульфид аммония
Основные соли:
 CuOHBr CuOH+ +Br - гидроксобромид меди (II) (бромид гидроксомеди (II))
CuOHBr CuOH+ +Br - гидроксобромид меди (II) (бромид гидроксомеди (II))
 Fe(OH)2N03 Fe(OH)2+ +NO3 - дигидроксонитрат железа (III)
Fe(OH)2N03 Fe(OH)2+ +NO3 - дигидроксонитрат железа (III)
 (NiOH)2S04 2NiОН+ + S042- гидроксосульфат никеля (II)
(NiOH)2S04 2NiОН+ + S042- гидроксосульфат никеля (II)
Двойные соли:
 K2SO4 . A12(SO4)3 2К+ + 2А13+ + 4SO42 - сульфат
K2SO4 . A12(SO4)3 2К+ + 2А13+ + 4SO42 - сульфат
или
калия-
 KA1(SO4)2 К+ + А13+ + 2SO42- алюминия
KA1(SO4)2 К+ + А13+ + 2SO42- алюминия
Комплексные соли:
[Ag(NH3)2] Сl- хлорид диаминсеребра (I)
 K3[Fe(CN)6] ЗК+ + [Fe(CN)6]3- гексацианоферрат (III) калия
K3[Fe(CN)6] ЗК+ + [Fe(CN)6]3- гексацианоферрат (III) калия
3. Физические свойства.
Большинство солей являются твердыми веществами с ионной кристаллической решеткой. Соли s- и р-металлов, как правило, бесцветны. Многие соли d-элементов окрашены.
Растворимость солей в воде варьируется в широких пределах. Хорошо растворимыми являются практически все соли натрия, калия, аммония; соли азотной кислоты (нитраты), соляной кислоты (хлориды), уксусной кислоты (ацетаты).
Плохо растворимы в воде многие фосфаты (соли Н3РO4), карбонаты (соли Н2СО3), сульфиды (соли H2S).
4. Химические свойства.
Характерными для солей являются следующие типы реакций:
1) реакции ионного обмена, в ходе которых катионы или анионы солей образуют малодиссоциирующие или малорастворимые вещества при связывании с ионами реагентов;
2) окислительно-восстановительные реакции, в ходе которых катионы или анионы солей выступают либо в роли окислителей, либо в роли восстановителей;
3) реакции разложения солей, происходящие без переноса электронов.
а) Реакция ионного обмена (реакции данного типа возможны, если хотя бы один из продуктов реакции представляет собой: а) слабый электролит; б) осадок; в) газообразное вещество).
Взаимодействие с растворами щелочей (возможны для растворимых солей)
CuSO4 + 2NaOH = Cu(OH)2 â + Na2SO4
Cu 2+ + 2OH - = Cu(OH)2
NH4NO3 + KOH = KNO3 + NH3 á + H2O
NH4+ + OH- = NH3 á + H2O
Na2CO3 + Ba(OH)2 = 2NaOH + BaCO3
CO32- + Ba2+ = BaCO3
КНСО3 + КОН = K2CO3 + Н2O
(кислая соль) (нормальная соль)
НСO3- + ОН- =СО32+ + Н
Fe(OH)2Cl + NaOH = Fe(OH)3 â + NaCl
(основная соль)(основание)
Fe(OH)2+ + OH = Fe(OH)3
Взаимодействие с кислотами:
Na2CO3 + 2НС1 = 2NaCl + СO2 á + H2O
СO32- + 2Н+ = СO2 á + Н2O
СаСОз + 2НС1 = СаС12 + СO2 á + Н2O
СаСОз + 2Н+ = Са2+ + СO2 + Н2O
NaHCO3 + HC1 → CO2 á + H2O +NaC1
Na2S + H2S = 2NaHS
(нормальная (кислая соль)
соль)
S2- + H2S = 2HS
MgOHCl +HC1 = MgCl2 + Н2O
(основная соль) (нормальная соль)
MgOH ++ Н+ = Mg2+ + Н2O
AgNO3 +HC1 = AgCl â +HNO3
Ag+ + Cl - = AgCl
ВаС12 + H2SO4 = BaSO4 â + 2НС1
Ba2+ + SO42-= BaSO4
Pb(NO3)2 + H2S = PbS â + 2HNO3
Pb2+ + H2S = PbS + 2H+
Взаимодействие солей друг с другом (возможны для растворимых солей):
AgNO3 + NaCl = AgCl â + NaNO3
Ag+ + CI- = AgCl
Ba(NO3)2 + K2S04 = BaSO4 â + 2KNO3
Ba2+ + SO42- = BaSO4
CaCl2 + Na2CO3 = CaCO3 â + 2NaCl
Ca2+ + CO32- = CaCO3
Zn(NO3)2 + K2S = ZnSâ + 2KNO3
Zn2+ + S2- = ZnS
NH4HCO3 + NaCl = NaHCO3 â + NH4Cl
HCO3 - + Na+ = NaHCO3
2K3[Fe(CN)6] + 3FeSO4 = Fe3[Fe(CN)6]2 â + 3K2SO4
2[Fe(CN)6]3- + 3Fe2+ = Fe3[Fe(CN)6]2
FeCl3 + 3NH4SCN à Fe(SCN)3 + 3NH4C1
ß
Fe3+ + 3SCN à Fe(SCN)3 (слабый электролит)
ß
Многие обменные реакции являются качественными реакциями на катионы и анионы: реакция (2) - на катионы NH4+; реакции (6, 7, 8) - на анион СO32-; реакции (11, 14) - на катион Ag+ и анион Сl-; реакции (12,15) - на катион Ва2+ и анион SO42-; реакция (13) - на анион S2-; реакция (19) - на катион Fe2+; реакция (20) - на катион Fe3.
б) Окислительно-восстановительные реакции
Реакции, в которых катионы соли играет роль окислителя
а) взаимодействие растворов солей с металлами (более активные металлы восстанавливают менее активные металлы из растворов их солей):
+2 0
CuSO4 + Fe = Сu + FeSO4
+2 0
Hg(NO3)2 + Сu = Hg + Cu(NO3)2
б) взаимодействие растворов солей с другими восстановителями:
+1 0
8 AgNO3 + РН3 + 4Н2O = 8Ag + Н3РO4 + 8HNO3
Реакции, в которых катион соли играет роль восстановителя
+2 +3
2FeCl2 + С12 = 2FeCl3
+2+3
4СгС12 + 4НС1 +O2 = 4СгС13 + 2Н2O
+3 +6
2СгС13 + 3NaBiO3 + 7NaOH + H2O = 2Na2CrO4 + 3Bi (OH)3 + 6NaCl
Реакции, в которых анион соли играет роль окислителя
+6 +3
К2Сг2O7 + 3H2O2 + 4H2SO4 = Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
+7 +4
2КМnO4 + 3С2Н4 + 4Н2O = 2МnO2 â + 3С2Н4(ОН)2 + 2КОН
Реакции, в которых анион соли играет роль восстановителя:
0
2Кl - + C12 = l 2 + 2KC1
+3 +6
2КСrO2 + 3РbO2 + 2KOH = 2К2СrO4 + 3РbО + Н2O
Реакции, в которых и катион, и анион соли играют роль восстановителей:
+2 -1 t +3 +4
4FeS2 + 11O2= 2Fe2O3 + 8SO2
+2 -2+3 0
10FeS + 36HNO3 = 10Fe(NO3)3 + 10S + 3N2 + 18H2O
(разб.)
Реакция внутримолекулярного окисления-восстановления:
+5 -2 t, кат -1 0
2КСlO3 = 2КС1 + 3O2á
+5 t + 4 0
2Cu(NO3)2 = 2CuO + 4NO2 á + O2á
+7 -2 t +6 +4 0
2KMnO4 = K2MnO4 + MnO2 + O2 á
в) Реакции разложения солей, происходящие без переноса электронов.
Если анион соли не проявляет окислительных свойств, то такие соли, как правило, разлагаются без изменения степеней окисления:
t
СаСO3 = СаО + СO2 á
t
Mg(HCO3)2 = Mg(OH)2â+ 2СO2 á
t
(CuOH)2CO3 = 2CuO + СO2 á + H2O
(NH4)2SO4 = NH3 á+ NH4HSO4
5. Способы получения солей.
Ниже представлены способы получения солей на примере растворимой соли бескислородной кислоты (хлорид натрия) и нерастворимой соли кислородосодержащей кислоты (сульфат бария).
| Получение NaCl | |
| осн. + к-та | NaOH + НС1 = NaCl + H2O |
| осн. оке. + к-та | Na2O + 2 НС1 = 2NaCl + H2O |
| Me + к-та | 2Na + 2HCl = 2NaCl + H2 á |
| щелочь + соль | 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 â |
| соль + кислота | Na2CO3 + 2НС1 = 2NaCl + CO2 á+ H2O |
| соль + соль________________ | Na2SO4 + BaCl2 = 2NaCl + BaSO4_______________________________ |
| Me + HeMe | 2Na + Cl2 = 2NaCl |
| гидрид +к-та | NaH + HCl = NaCl + H2á |
| Получение BaSO4 | |
| осн. + к-та | Ba(OH)2 + H2SO4= BaSO4 â + 2H2O |
| осн. оке. + к-та | BaO + H2S04 = BaSO4 â + H2O |
| Me + к-та | Ba + H2SO4 = BaSO4 â + H2 á (разб.) |
| щелочь + соль | Ba(OH)2 + Na2SO4 = BaSO4 â + 2NaOH |
| соль + кислота | BaCl2 + H2SO4 = BaSO4 â + 2НС1 |
| соль + соль________________ | Ba(NO3)2 + Na2SO4 = BaSO4 â + 2NaNO3 |
| осн. оке. + кисл. оке. | BaO + SO3 = BaSO4 |
| Щелочь + кисл. оке. | Ba(OH)2 + SO3 = BaSO4 â + H2O |
Первые 6 способов получения являются идентичными для обеих солей.
Вопросы для самоподготовки:
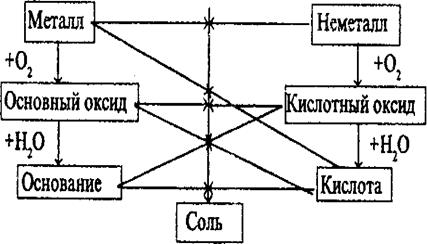
С помощью уравнений химических реакций осуществите генетическую связь между классами неорганических веществ
|
Лекция №8
Тема: Амфотерность. Химические свойства амфотерные оксидов и гидроксидов. Генетическая связь между классами неорганических соединений.
План
1. Амфотерные оксиды.
2. Амфотерные гидроксиды; определение и важнейшие представители; физические свойства.
3. Химические свойства:
а) основные свойства;
б) кислотные свойства;
в) термическое разложение.
4. Способы получения.
5. Генетическая связь между классами неорганических соединений.
1. Амфотерные оксиды.
Амфотерные оксиды, обладая свойствами и основных и кислотных оксидов, взаимодействуют с сильными кислотами и щелочами:
ZnO (как основный оксид) + 2НС1 (раствор) = ZnCl2 + H2O
ZnO (тв., как кислотный оксид) + 2NaOH (тв.) = Na2ZnO2 (цинкат натрия) + Н2О
или в растворе щелочи:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
ZnO + 2 ОН - + Н2O = [Zn(OH)4]2-
2. Амфотерные гидроксиды; определение и важнейшие представители;
физические свойства.
Амфотерные гидроксиды - слабые электролиты, которые способны диссоциировать как с образованием ионов Н+ (по типу кислоты), так и с образованием ионов ОН- (по типу основания).
Диссоциация по кислотному типу усиливается в щелочной среде, а по основному типу - в кислой среде:
ОН Н+
 Н+ + МеО- МеОН Ме+ + ОН –
Н+ + МеО- МеОН Ме+ + ОН –
Важнейшие представители:
| Форма основания | Форма кислоты |
| Zn(OH)2 гидроксид цинка | H2ZnO2 Цинковая кислота |
| А1(ОН)3 гидроксид алюминия | Н3А1O3 - ортоалюминевая к-та НАlO2 - метаалюминиевая к-та |
| Сr(ОН)3 гидроксид хрома (III) | Н3СrОз - ортохромистая к-та НCr02 - метахромистая к-та |
| Ве(ОН)2 гидроксид берилия | Н2ВеO2 бериллиевая к-та |
| Sn(OH)2 гидроксид олова (II) | H2SnO2 оловяннистая к-та |
| Sn(OH)4 гидроксид олова (IV) | H4SnO4 - ортооловяная к-та H2SnO3 - метаоловянная к-та |
| Рb(ОН)2 гидроксид свинца (II) | Н2РbO2 - свинцовая к-та |
| Рb(ОН)4 гидроксид свинца (IV) | Н4РbO4 - ортосвинцовая к-та Н2РbОз - метасвинцовая к-та |
Физические свойства: все амфотерные гидроксиды представляют собой твердые вещества, плохо растворимые в воде.
3. Химические свойства.
Проявляя свойства очень слабых оснований и очень слабых кислот, амфотерные гидроксиды взаимодействуют с сильными кислотами и с сильными основаниями (щелочами).
а) Основные свойства.
В результате реакций с кислотами в раствор переходят катионы металлов, входящих в состав амфотерных гидроксидов; например:
 Zn(OH)2 + 2НС1 ZnCl2 + 2Н2O
Zn(OH)2 + 2НС1 ZnCl2 + 2Н2O
 Zn(OH)2 + 2H+ Zn2+ + 2H2O
Zn(OH)2 + 2H+ Zn2+ + 2H2O
 2Al(OH)3 + 3H2SO4 A12(SO4)3 + 6H2O
2Al(OH)3 + 3H2SO4 A12(SO4)3 + 6H2O
 Al(OH)3 + 3H+ A13+ + 3H2O
Al(OH)3 + 3H+ A13+ + 3H2O
 б) кислотные свойства.
б) кислотные свойства.
Co щелочами амфотерные гидроксиды могут взаимодействовать при высокой температуре в расплавах; при этом образуются соли, содержащие кислотные остатки метакислотных форм амфотерных гидроксидов, например:
t
А1(ОН)3 + NaOH = NaAlO2 + 2Н2O
метаалюминат
натрия
t
2Сr(ОН)3 + Ва(ОН)2 = Ва(СrO2)2 + 4Н2O
метахромит бария
При взаимодействии амфотерных гидроксидов с растворами щелочей образуется гидроксокомплексы с координационным числом, как правило, 4 или 6; например:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] - тетрагидроцинкат натрия
Zn(OH)2 + 2OН - = [Zn(OH)4]2-
А1(ОН)3 + NaOH = Na[Al(OH)4] - тетрагидроксоалюминат натрия
А1(ОН)3 + ОН - = [AL(OH)4] -
или:
А1(ОН)3 + 3NaOH = Na3[Al(OH)6] - гексагидроксоалюминат натрия
А1(ОН)3 + 3ОН - = [А1(ОН)6]3 -
в) термическое разложение.
Как и нерастворимые основания, амфотерные гидроксиды разлагаются при нагревании (дегидратируются):
t
2А1(ОН)3 = А12O3 + 3Н2O
4. Способы получения.
а) Подробно нерастворимым основаниям, амфотерные гидроксиды можно
осаждать щелочами из растворов соответствующих солей, избегая избытка
щелочи:
А1С13 + 3NaOH = А1(ОН)3 â + 3NaCl
А13+ + 3ОН - = А1(ОН)3
ZnSO4 + 2KOH = Zn(OH)2 â +K2SO4
Zn2+ + 2OH - = Zn(OH)2
б) Амфотерные гидроксиды выделяются также в процессе разрушения
гидроксокомплексов при действии кислот:
К3[Сr(ОН)6] + ЗНС1 = Сr(ОН)3 â + 3КС1 + 3Н2O
[Cr(OH)6]3 - + 3Н+ = Сr(ОН)3 + 3Н2O
или при растворении в растворах кислот цинкатов, метаалюминатов и т.д.:
Na2ZnO2 + 2HC1 = Zn(OH)2 â + 2NaCl
ZnO22 - + 2Н+ = Zn(OH)2
NaAlO2 + HC1 + H2O = Al(OH)3 â + NaCl
AlO2 - + H+ + H2O = Al(OH)3
Во всех этих реакциях следует брать строго рассчитанное количество кислоты, поскольку в избытке кислоты образующиеся амфотерные гидроксиды растворяются.
5. Генетическая связь между классами неорганических соединений.
Многочисленные способы получения солей из веществ, принадлежащих к разным классам, свидетельствует о том, что между этими классами неорганических веществ существует тесная взаимосвязь.
Связь между классами неорганических соединений, которые основаны на получении веществ одного класса из веществ другого класса, называется генетической.
Генетическая связь между важнейшими классами неорганических веществ проиллюстрировано на следующей схеме:
 Металл
Металл
|

 Неметалл Неметалл
|

 +O2
+O2 
 +O2
+O2
| Основный |     оксид оксид
|
| Кислотный | оксид |

 +H2O +H2O
+H2O +H2O
Основание
|
| Кислота |
| соль |
Сходящиеся стрелки в этой схеме показывают взаимодействие тех веществ, от которых они направлены, с образованием солей.
1. Me + неМе
2. Ме + O2
3. МеО + Н2O
4. неМе + О2
5. неМеО + Н2O
6. МеО + неМеО
7. МеОН + неМеО
8. НАu + МеО
9. МеОН + НАu
10. Ме + НАu
Взаимосвязь классов неорганических соединений
| Неметалл | Кислотный оксид | Кислота | Соль | Вода | |
| Металл | Соль1 | Соль2 + водород | 1 Соль3 + металл | Основание4 или основной оксид и водород | |
| Основный оксид | - | 1 Соль | Соль + вода | - | Основание5 |
| Основание | - | 1 Соль + вода6 | Соль + вода | Соль + основание7 | - |
| Соль | - | - | Соль + кислота8 | Соль + соль | Продукты |
| гидролиза | |||||
| Вода | - | Кислота* | - | Продукты гидролиза | - |
Дата добавления: 2016-11-22; просмотров: 2227;
