Классификация, состав, номенклатура оксидов, кислот, оснований. Способы получения и их химические свойства. 4 страница
Все эти явления свидетельствуют об изменении химической природы компонентов раствора в процессе его образования. Д.И. Менделеев, изучая состояние веществ в растворах, развил представление о химическом характере процесса растворения, противопоставляя это учение физической теории растворения, согласно которой растворы - чисто механические смеси частиц растворителя и растворенного вещества. Он пришел к выводу, что в растворе образуются соединения, состоящие из растворенного вещества и растворителя. Такие соединения получили название сольватов. Если растворителем является вода, то соединения, образующиеся в растворе, называются гидратами. Развитая Менделеевым химическая, или гидратная теория лежит в основе всего современного учения о растворах.
С термодинамической точки зрения растворение всегда сопровождается убылью энергии Гиббса. При этом независимо от знака изменения энтальпии при растворении всегда д G < 0, так как переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочению. Раствор, в котором при данных условиях невозможно дальнейшее растворение вещества, называется насыщенным относительно данного вещества. Насыщенный раствор можно определить как раствор, находящийся в динамическом равновесии с осадком растворяемого вещества.
Растворы с меньшей концентрацией называются ненасыщенными.
Раствор, содержащий больше растворенного вещества, чем это определяется его растворимостью, называется пересыщенным. Пересыщенный раствор представляет собой неустойчивую систему. При любом внешнем воздействии (встряхивании, внесении кристалла затравки) в системе происходят необратимые изменения, сопровождающиеся осаждением избыточного количества растворенного вещества.
Разбавленный раствор - это раствор, в котором содержание растворенного вещества очень мало по сравнению с содержанием растворителя.
2. Растворимость. Факторы, влияющие на растворимость.
Растворимость - это способность одного вещества растворяется в другом. Количественно растворимость твердых веществ и жидкостей определяется коэффициентом растворимости.
Коэффициент растворимости выражается массой безводного вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора. Растворимость газов определяется объемом газа, растворяющегося при постоянной температуре в одном объеме растворителя с образованием насыщенного раствора.
Коэффициент растворимости большинства твердых веществ при повышении температура возрастает. Однако известны вещества, растворимость которых с ростом температуры понижается. К их числу относиться, например, карбонат и сульфат кальция, гидроксиды кальция и магния и другие. Понижение растворимости с температурой иногда связано с переходом в менее гидратированную форму.
Если насыщенный раствор, приготовленный при повышенной температуре, охлаждать, то вследствие уменьшения растворимости часть растворенного вещества будет выпадать в осадок. Это явление часто используют для очистки веществ перекристаллизацией.
В воде растворяются не только твердые вещества, но и многие жидкости. Одни из них, например, спирт, глицерин, серная кислота смешиваются с водой в любых соотношениях, другие, например эфир, растворяется только до определенного предела. С увеличением температуры растворимость жидкого вещества, как правило, повышается.
Растворимость газов в воде весьма различна. Растворимость азота, водорода, кислорода очень мала (в 1 л воды при t ° =0 °С и давлении 0,1 МПа растворимость водорода - 20 мл, кислорода - 40 мл, азота - 21 мл; растворимость аммиака и хлороводорода, наоборот, велика). Растворимость газа в воде зависит от природы газа, температуры и давления. При неизменной температуре растворимость газов увеличивается с повышением давления; При неизменном давлении с увеличением температуры растворимость газов уменьшается.
3. Дисперсные системы и их классификация.
Дисперсные системы - такие системы, в которых одно вещество равномерно распределено в виде частиц в другом веществе.
В таких системах различают дисперсную среду и дисперсную фазу (раздробленное в дисперсионной среде вещество).
Одной из характеристик дисперсных систем является степень дисперсности, то есть средний размер частиц дисперсной фазы. По степени дисперсности дисперсные системы делятся на:
а) грубодисперсные (средний размер частиц более 100 нм; взвеси);
б) тонко (высоко) дисперсные или коллоидные системы (диаметр частиц
от 1 до 100 нм);
в) истинные растворы (диаметр частиц менее 1 нм)
От степени дисперсности зависят свойства дисперсных систем, их устойчивость.
Характерным признаком взвесей служит их нестабильность во времени. Они расслаиваются, причем диспергированная фаза выпадает в виде осадка или всплывает в зависимости от соотношения плотностей. Примерами взвесей могут служить туман (жидкость, распределенная в газе - дисперсионная среда газообразная; дисперсионная фаза - жидкая); дым (газообразная среда и твердая
фаза); суспензии (жидкая среда и твердая фаза); эмульсии (жидкая среда и жидкая фаза); пена (жидкая среда и газообразная фаза).
Истинный раствор низкомолекулярного вещества имеет дисперсионную фазу в виде ионов, молекул (растворы натрия хлорида, магния сульфата, глюкозы).
Истинный раствор высокомолекулярного вещества имеет дисперсионную фазу в виде макромолекул, макроионов (раствор пепсина, желатина).
По происхождению (природе) дисперсионные среды можно классифицировать на:
а) природные - неорганические (вода очищенная);
органические (этанол, глицерин, масла, жирные и минеральные);
б) синтетические и полусинтетические - органические (димексид); эле-
ментоорганические (полиорганосилоксановые жидкости).
По размеру (величине) молекул дисперсионные среды могут быть низкомолекулярными (вода, глицерин, этанол) и высокомолекулярными веществами и олигомерами (полиэтиленоксид - 400).
По степени гидрофильности: гидрофильные (вода, глицерин); липофиль-ные (жирные и минеральные масла, хлороформ, эфир); дифильные (этанол, димексид).
По назначению различают: собственно дисперсионные среды (в растворах защищенных коллоидов, суспензиях, эмульсиях, сложных микстурах); растворители (в истинных растворах низко - и высокомолекулярных веществ); экстрагенты (для получения водных извлечений, экстракционных препаратов разной природы).
К дисперсионным средам предъявляют определенные требования:
а) должны обладать растворяющей способностью или обеспечивать достижение оптимальной дисперсности;
б) не подвергаться микробной контаминации;
в) быть химически индифферентными, биологически безвредными;
г) обладать оптимальными органолептическими свойствами;
д) быть экологически выгодными.
4. Коллоидные растворы и их свойства.
Промежуточное положение по степени дисперсности и свойствам занимают коллоидные растворы. В них частицы диспергированного вещества представляют собой относительно простые агрегаты с размерами, промежуточными между истинными растворами и взвесями.
С этой точки коллоидные растворы можно рассматривать как микрогетерогенные системы.
Коллоидные растворы иначе называют золями. Размер частиц дисперсионной фазы от 1 до 100 нм. Золи в зависимости от размеров частиц могут иметь различную окраску. Например, золи золота могут быть синими, фиолетовыми, вишневыми, рубиново-красными, чего не наблюдается у истинных растворов.
В отличие от истинных растворов для золей характерен эффект Тиндаля -коллоидные частицы рассеивают свет (при пропускании через золь пучка света появляется светлый конус, видимый в затемненном помещении).
Прохождение луча света через коллоидный раствор:
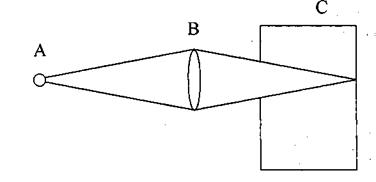
|
А - источники света
В - линза
С - коллоидный раствор
На основе эффекта Тиндаля устроен ультрамикроскоп.
Основываясь на различной величине частиц коллоидных и истинных растворов, можно разделить их смесь: подбирают пористую перепонку (пергаментную бумагу, животный пузырь) с таким мелкими порами, через которые коллоидные частицы пройти не могут, а проходят только молекулы и ионы. Такой способ освобождения золя от частиц истинного раствора называется диализом; прибор -диализатор.
Коллоидные частицы называются мицеллами. Они не проходят через оболочку живой клетки, практически не обладают осмотическим давлением, совершают броуновское движение под действием молекул дисперсионной среды.
Строение мицеллы на примере образования раствора йодида серебра:
AgN03 + KJ = AgJ â + KN03
разб. разб.
Нерастворимые молекулы йодида серебра образуют ядро коллоидной частицы: [mAgJ]
Ядро адсорбирует на своей поверхности ионы, имеющиеся в растворе, (в данном случае Ag+ или J -).
Если коллоидный раствор получают при избытке йодида калия, то адсорбируются ионы йода, достраивают кристаллическую решетку ядра и образуют адсорбционный слой и придают ядру отрицательный заряд (m[Ag]nJ -). Ионы, адсорбирующиеся на поверхности ядра и придающие ему соответствующий заряд, называются потенциал определяющими ионами.
В растворе находятся также противоионы (противоположные по знаку ионы К+). Они электростатически притягиваются потенциалопределяющими ионами адсорбционного слоя.

 Ядро с адсорбционным слоем называется гранулой.
Ядро с адсорбционным слоем называется гранулой.
[mAgJ]nJ -(n-x)K+ x-
Оставшаяся часть противоионов образует диффузный слой ионов (хК+)
X-

 [mAgJ]nJ -(n-x)K+ хК+
[mAgJ]nJ -(n-x)K+ хК+

мицелла
Наличие одноименного заряда у всех гранул данного золя является важным фактором его устойчивости.
Однако частицы дисперсной фазы очень малы, имеют большую удельную поверхность, следовательно, система имеет большой запас свободной поверхностной энергии, которая стремиться к уменьшению, что может стать причиной укрупнения (агрегации) частиц, особенно при наличии дестабилизирующих факторов.
При добавлении к золям электролитов происходит уменьшение зарядов гранул, что приводит к слипанию частиц. Соединение коллоидных частиц в более крупные агрегаты называется коагуляцией. В результате коагуляции частицы могут или выпасть в осадок под влиянием силы тяжести (этот процесс называется седиментацией) или образовать полутвердую упругую массу (гель или студень).
Коагуляцию проводят прибавлением к золю электролита (заряды коллоидных частиц нейтрализуются и золи, содержащие положительно заряженные частицы коагулируют под действием анионов, а золи, содержащие отрицательно заряженные частицы - под действием катионов); прибавлением другого золя, частицы которого имеют противоположительный заряд (заряды частиц нейтрализуются, происходит взаимная коагуляция); проводят нагреванием (нагревание уменьшает адсорбцию ионов коллоидными частицами, уменьшая их заряд, что способствует коагуляции).
Если вокруг коллоидной частицы имеется оболочка, состоящая из молекул дисперсионной среды, такие растворы называют лиофильными (любящими жидкость). Если дисперсионной средой является вода, т.е. называют гидрофильными. Если коллоидная частица не имеет сродства к дисперсионной среде, то коллоидные растворы называют лиофобными или гидрофобными (не любящими воду). Гидрофобные коллоиды легко коагулируют.
Австрийский химик Р.Зигмонди (1865-1929) установил, что лиофобный коллоид в смеси с раствором лиофильного коллоида более стоек. Это явление названо коллоидной защитой.
По сравнению с суспензиями и эмульсиями устойчивость коллоидных растворов, применяемых в медицине, повышают за счет коллоидной.защиты. Защитный слой (например, белок) обеспечивает сольвацию (гидратацию) частиц. Благодаря защите гидрофобных коллоидов путем адсорбции макромолекул ВМВ, они приобретают способность самопроизвольно растворяться и агрега-тивную устойчивость - способность частиц дисперсной фазе противостоять слипанию, т.е. агрегации.
Большой размер и наличие белковой защитной оболочки приближает свойства растворов защищенных коллоидов к растворам ВМВ.
Процесс, обратный коагуляции, называется пептизацией. Он наблюдается при промывании осадков водой. При этом ионы электролита - коагулянта вымываются, частицы осадка снова преобразуют заряды и переходят в состояние золя. Пептизации легко подвергаются осадки сульфидов.
Значение золей очень велико, они боле распространены, чем истинные растворы. Протоплазма живых клеток, кровь, соки растений - все это коллоидные растворы. Коллоидные растворы широко применяются в различных технологических процессах: в мыловаренной, бумажной, текстильной промышленности, в фармацевтическом производстве.
В аптечной практике коллоидные растворы применяют ограниченно, что в значительной степени связано с их нестабильностью. В таких растворах самопроизвольно может происходить коагуляция (слипание частиц), которая протекает, как правило, в две стадии: скрытая и явная. Коагуляция может быть вызвана добавлением электролитов, веществ, вызывающих дегидратацию (водо-отнимающих веществ: спиртов, сиропов и др.), изменением температуры, механическим воздействием, светом, электрическим током, изменением состава дисперсионной среды и другими факторами.
Практическое применение в аптечной практике нашли растворы защищенных коллоидов (колларгола, протаргола, провиаргола, ихтиола), дубильных веществ (танина, этакридина лактата, экстрактов). Коллоидная дисперсия может иметь место и при получении водных извлечений.
Коллоидную защиту применяют при получении в промышленности препаратов серебра: протаргола и колларгола. В этих препаратах серебро находится в неионизированном состоянии.
Протаргол (Protargolum) — коллоидный препарат оксида серебра (содержание серебра 8—9 %).
Колларгол (Collargolum. Argentum colloidale) содержит не менее 70 % серебра.
Типичным защищенным коллоидом природного происхождения является ихтиол, представляющий собой смесь сульфидов, сульфатов и сульфонатов. получаемых из продуктов сухой перегонки битуминозных сланцев (аммониевая соль сульфокислот сланцевого масла). Ихтиол - сиропообразная жидкость, растворимая в воде и частично в этаноле.
Принцип защиты коллоидов заключается в сочетании коллоидно-раздробленного вещества (по своей природе гидрофобного) с высокомолекулярными веществами (гидрофильными). Стабилизирующее действие в раство-
pax колларгола и протаргола оказывают натриевые соли продуктов гидролиза яичного белка, в растворе ихтиола - природные ПАВ.
Растворы колларгола и протаргола применяют в качестве вяжущих, антисептических, противовоспалительных средств местного действия смазывания слизистой оболочки верхних дыхательных путей, промывания мочевого пузыря, гнойных ран, в офтальмологии.
5.Классификация способов выражения количественного состава растворов.
Для качественной характеристики растворов используют понятия «разбавленный раствор» и «концентрированный раствор». При работе с растворами необходимо знать их количественный состав. Количественный состав раствора выражается концентрацией.
Концентрация-это величина, характеризующая относительное содержание данного компонента в смеси или растворе.
В практической деятельности используют различные способы выражения концентраций. Понятие концентрации в медицине распространяется не только на растворы, но и на биологические жидкости, на клетки и ткани, которые можно рассматривать как сложные смеси веществ. Живой организм поддерживает постоянные концентрации метаболитов - это одно из проявлений гомео-стаза. Отклонение концентрации веществ в биологических жидкостях и тканях от нормы служит важным показателем состояния организма, признаком различных заболеваний. Изучая результаты клинических анализов, необходимо применять всесторонние знания способов выражения концентраций. При изготовлении лекарственных препаратов и их дозировке знание концентраций является абсолютно необходимым. На измерении концентраций основана количественная характеристика компонентов окружающей среды, санитарный контроль за состоянием окружающей среды.
Количественный состав растворов может выражаться различными способами. Некоторые из них требуют высокой точности приготовления и называются растворами с аналитическими концентрациями. Такие растворы готовятся с использованием точных расчетов, аналитических весов, специальной мерной посуды. Растворы, которые не требуют специальных, высокоточных посуды и оборудования относятся к техническим способам выражения концентрации.
К техническим способам выражения концентрации растворов, применяемых в биологии, медицине, фармации, относятся:
A) массовая процентная концентрация Б) объемная процентная концентрация;
B) массо -. объемная процентная концентрация.
Г) к аналитическим способам выражения концентраций растворов относятся:
Д) молярная концентрация;
Е) молярная концентрация эквивалента (нормальная концентрация);
Д) титр раствора.
Растворы технических и аналитических концентраций требуют разной техники приготовления.
Концентрацией раствора называется массовое содержание растворенного вещества в определенном массовом количестве или определенном объеме раствора.
6.Массовая процентная концентрация (массовая доля растворенного вещества).
Массовой долей растворенного вещества называется отношение массы растворенного вещества к массе раствора:
W= mр.в./ mр.ра.
где W-массовая доля растворенного вещества, выраженная в долях единицы;
m р.в. - масса растворенного вещества, г ;
m р.р - масса раствора, г.
Массовую долю можно выражать также в процентах:
W= mр.в./mрра ∙ 100%
Массовую долю растворенного вещества, выраженную в процентах, называют процентной концентрацией раствора.
Пример: в водном растворе хлорида натрия NaCL его массовая доля равна 10% или 0,1.Это значит, что в растворе массой 100 г содержится 10 г хлорида натрия и 90 г воды.
Массу раствора можно рассчитать по формулам:
m р - ра = m растворителя + m растворенного вещества;
m р - ра = r . V, где V - объем раствора; мл;
р - плотность раствора г/мл;
Алгоритм приготовления раствора с заданной процентной концентрацией:
1.Рассчитать массы растворенного вещества и растворителя по соответствующим формулам.
2.Взвесить навеску растворяемого вещества на технохимических весах: 3.Высыпать навеску в стакан.
4.Измерить мерным цилиндром необходимый объем дистиллированной воды. 5.Вылить воду в химический стакан с растворяемым веществом. б.Перемешать раствор стеклянной палочкой до полного растворения вещества.
Типовая задача № 1
В растворе массой 100 г содержится хлорид бария массой 20 г. Какова
массовая доля хлорида бария в растворе?

Дано: Решение:
m (р-ра) =100 г Массовая доля ВаСl2 равна отношению его массы к
m (BaCl2)=20 г к общей массе раствора:

Найти: W% (BaCl2) w% (ВаСl2) = m(BaCl2) = 20 = 0,2.
m (р-ра) 100 г
Ответ: w% (ВаСl2) = 0,2 , или 20%.
Типовая задача № 2.
Сахар массой 5 г. растворили в воде массой 20 г. Какова массовая доля (%) сахара в растворе?
| Дано: т(сахара)=5 г; т(Н2О)=20 г. |
Решение:
1.Определим общую массу полученного раствора:
m(р-ра) =m(воды) + m(сахара);
m(р-ра) = 20 г + 5 г = 25 г.
| Найти: W% (сахара). |
 m(р-ра) = 20 г + 5 г = 25 г.
m(р-ра) = 20 г + 5 г = 25 г.
2.Вычислим массовую долю (%) сахара в растворе:
W% (сахара) = m(сахара) . 100%
m(р-ра)
W% (сахара) = 5 .100% = 20%
25 г

Ответ: w % (сахара) = 20%.
Типовая задача № 3.
Какие массы нитрата калия и воды необходимо взять для приготовления 2 кг раствора с кассовой долей KN03, равной 0,05?
| Дано: m(p-pa)= 2 кг = 2000 г; W(KNO3)=0,05 |

Решение:
1. Определим массу нитрата калия:
W(KNOO=m(KNOI) . m(p- pa)
m(KN03)= w(KN03) . m(p-pa)
 m(KNO3)=0,05 . 2000 r. = 100 r.
m(KNO3)=0,05 . 2000 r. = 100 r.
Найти: 2.Определим массу воды:
W%(сахара) m(p-pa) = m(H20) + m(KN03);
m(H20) = m(p-pa) - m(KN03);
m(H20) =2000 r-100 г=1900 г
Ответ: m(KN03) = 100 г; m(H20)=1900r
Типовая задача № 4.
Какие массы кристаллогидрата сульфата натрия Na2S04 • 10Н2О и воды надо взять, чтобы получить раствор массой 71 г с массовой долей Na2S04 20% ?
 Дано:
m (р-ра) = 71 г
W%(Na2S04) = 20%, Дано:
m (р-ра) = 71 г
W%(Na2S04) = 20%,
|
Решение:
1.Вычислим массу Na2S04, необходимую для приготовления 71 г раствора:
W%(Na7S04) = m(Na2SQ4) . 100%
| Найти: m(Na2SO4i0H2O), m (H20) |
 m(p-pa)
m(p-pa)
m (Na2so4); = m(p-pa) . W;
100%
m Na2SO4)=71г . 20%= 14,2 г
100%
2. Вычислим массу кристаллогидрата Na2S04 • 10H2O,
необходимого для приготовления раствора
М (Na2S04 • 10Н2О) = 322 г/моль;
M(Na2S04) = 142 г/моль;
322 г NaS04 • 10Н2О содержит 142 г. Nag2S04;
m г Na2S04 • 10Н2О содержит 14,2 г. Na2S04;
m Na2S04 - 10H2O ) -322 г . 14,2 г = 32,2 г
100 г
 3. Вычислим массу воды:
3. Вычислим массу воды:
m (р-ра) = m(H20) + m(Na2S04 • 10Н2О);
m (Н20) = m(р-ра) - m(Na2 S04 • 10Н2О);
m(Н20) = 71 г - 32,2 г = 38,8 г/
Ответ: Для приготовления 71 г раствора, где w% (Na2S04) = 20%,надо взять 32,2 г. NaS04 • 10Н2О и 38,8 г Н20.
Типовая задача № 5
 При выпаривании 500 г 10%-го раствора сульфата лития получили раствор массой 200 г. Какова процентная концентрация полученного раствора?
При выпаривании 500 г 10%-го раствора сульфата лития получили раствор массой 200 г. Какова процентная концентрация полученного раствора?
Дано:
m1 (р-ра) =500 г;
W2 (Li2SO4)=10%
m2(p-pa)=200 г.
 Найти: W2% (Li2S04)
Найти: W2% (Li2S04)
| 2. Определим процентную концентрацию полученного раствора (масса Li2S04 в растворе не изменилась): w2 (Li2S04) =m(Li2S(Xi) . 100% = 50 г . 100% = 25% m2 (р-ра) 200 г Ответ; w2 % (Li2S04) = 25%. |
Решение:
1.Определим массу Li2S04 в исходном растворе:
W%(Li2S04) = m(Li2SQ4) . 100%;
m(p-pa)
m(Li2S04) = W%(Li2SQ4) . m 1(p-pa);
100%
m(Li2S04) = 10%500г = 50 r.
100%
Типовая задача № 6
К 250 г 10%-ного раствора глюкозы прилили 150 мл воды. Какова массо-
вая доля (%) глюкозы в полученном после разбавления растворе?

Дано:
m(р-ра) =250 г
W1% (глюкозы) =
= 10%; V(Н2О)=150мл.

Найти:
W2% (глюкозы)
в полученном после разбавления растворе?
Решение:
1.Определим массу глюкозы в исходном растворе:
W% = m( глюкозы). 100%
m1(p-pa)
m1( глюкозы) = m(p-pa) w1= 250 . 0,1=25 г
100%
2.Macca глюкозы при разбавлении раствора не изменяется. Определим массу раствора, полученного после разбавления:
m2 (р-ра) = m1 (р-ра) + m (Н20);
m (Н20) = V . р = 150 мл . 1 г/мл = 150 г;
m2 (р-ра) = 250 г + 150 г = 400 г.
3. Определим W2% (глюкозы):
W2%(глюкозы) = m( глюкозы) . 100% = 25 г . 100% =6,25%
m2(р-ра) 400 г
Ответ: w2% (глюкозы) = 6,25%.
Типовая задача № 7.
В 200 г воды растворили 67,2 л газообразного хлороводорода НС1(н. у.). Определить массовую долю хлороводорода в полученном растворе.

Дано:
m (Н20) = 200 г. V ( HCI) = 67,2 л
Найти
W% (HCI)
Решение:
1. Определим количество вещества НСl:
n = V/VM;
n ( HCI) = 67,2 л/22,4 л/моль = 3 моль
2. Определим массу HCI:
m( HCI) = Mr (HCI) . n ( HCI) = 36,5 г/моль . 3 моль =
109,5 г

 3. Определим массу раствора:
3. Определим массу раствора:
m(р-ра) = m(Н20) + m( HCI) = 200 г + 109,5 г = 309,5 г
4. Определим массовую долю HCI в растворе:
W( HCI) = m(HCl) . 100% = 109,5 г . 100% = 35,38%
m(p-pa) 309,5 г
Ответ: W% ( HCI) = 35,38%.
Чтобы определить, в каком соотношении следует смешивать растворы, содержащие разные массовые доли одного и того же растворенного вещества, для получения раствора с заданной массовой долей этого вещества, можно применять правило смешивания или диагональную схему
Пример: в каком массовом соотношении следует смешивать 40% и 15% растворы, чтобы получить 35% раствор.
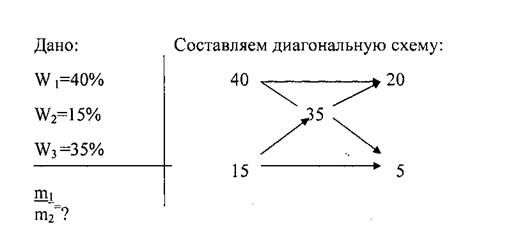
В центре пишем требуемую массовую долю (35). У левого конца каждой диагонали пишем исходные массовые доли (40; 15). Затем по диагонали производим вычитание (вычитают всегда из большей величины меньшую):
Дата добавления: 2016-11-22; просмотров: 1119;
