Классификация, состав, номенклатура оксидов, кислот, оснований. Способы получения и их химические свойства. 3 страница
1. Если неметалл - кислород, то образуется оксид.
2. Если метал в ряду напряжений стоит до водорода и если кислота сильная (кроме азотной и концентрированной серной).
3. Исходный металл должен обладать большей восстановительной активностью, чем металл, входящий в состав соли.
4. Металлы, расположенные в ряду напряжений от лития до натрия включительно, образуют основания; а от магния до никеля - оксиды. Остальные c водой не реагирует.
5. Исходные оксиды должны быть оксидами металлов главных подгрупп I и II групп (кроме бериллия и магния).
6. Основание должно быть растворимо.
7. Исходные вещества должны быть растворимы, а один из продуктов реакции - нерастворим.
8. Исходная кислота должна быть устойчивее, чем кислота, образовавшаяся соль.
9. SiO2 с водой не реагирует.
Вопросы для самоподготовки:
1. Осуществить превращения:
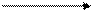 ZnCl2 à Zn(OH)2 à ZnSO4 à Zn(NO3)2
ZnCl2 à Zn(OH)2 à ZnSO4 à Zn(NO3)2
 á
á
 Zn Zn(NO3)2
Zn Zn(NO3)2
Na2ZnО2
2. Предложите способ получения оксида меди (II) CuO из сульфата меди (И), воды и металлического натрия.
3. Напишите уравнения реакций, доказывающие амфотерность гидроксида меди (II).
4. Предложите способ получения:
а) тетрагидроксоцинката натрия;
б) метаалюмината натрия.
Лекция № 9.
Тема: Комплексные соединения.
План:
1. Строение комплексных соединений. Теория Вернера.
2. Природа химической связи в комплексных ионах.
3. Классификация и номенклатура комплексных соединений
4. Диссоциация комплексных соединений
5. Применение комплексных соединений в медицине и химическом анализе.
1. Строение комплексных соединений. Теория Вернера.
В результате взаимодействия некоторых простых бинарных соединений друг с другом образуются новые, более сложные соединения - комплексные.
4KCN + Fe(CN)2 = K4[Fe(CN)6];
Комплексные соли при диссоциации образуют сложные комплексные ионы, которые способны существовать в растворе:
K4[Fe(CN)6] → 4K+ +[Fe(CN)6]4-
В водном растворе K4[Fe(CN)6] имеются катионы К+ и анионы [Fe(CN)6]4 - , но нельзя обнаружить ионы Fe2+ и CN -. Из этого следует, что они соединились и образовали сложный ион [Fe(CN)6]4 -, который называется комплексным. Состав комплексного соединения изображают химической формулой, в которой комплексный ион заключают в квадратные скобки. Образование двойных солей не ведет к существенным изменениям свойств исходных соединений, из которых они образовались.
Первая теория строения комплексных соединений была разработана швейцарским химиком А.Вернером в 1893г. Особый тип валентных сил, на котором основано образование комплексных соединений, был назван Вернером координационной связью, а теория получила название координационной.
Согласно теории Вернера, центральное место в комплексном соединении занимает комплексообразователь, или центральный атом. Комплексообразователями чаще всего являются катионы металлов. Наибольшую склонность к комплексообразованию проявляют ионы d -элементов: Aq+,Cu2+, Co3+, Fe3+, Fe2+ и др. Вокруг центрального атома находятся (или координируются) противоположно заряженные ионы или нейтральные молекулы, которые называются лигандами или аддендами. Комплексообразователь и лиганды образуют внутреннюю координационную сферу комплексного соединения, которая заключается в квадратные скобки. Число лигандов, которое связывается с комплексообразователем, называется координационным числом. Чаще всего они принимают значения 4, 6 и зависят от степени окисления центрального атома и природы лиганда.
Таблица 1 Координационные числа для ионов-комплексообразова гелей
| Координационное число | Ионы - комплексообразователи |
| Cu+ , Aq+, Au+ Cu2+, Co2+, Au2+, Zn2+, Pb2+, Pt 2, Al3+ Fe2+, Fe3+, Co3+, Ni2+, Al3+, Pt4+, Hg4+, Cr3+ |
В качестве лигандов выступают нейтральные молекулы (Н2O, NH3CO), ионы (NO2-. Сl -, Вr -, ОН - и др.). Каждый лиганд содержит определенное число атомов (донорных атомов), которые участвуют в непосредственном связывании с центральным атомом и образуют определенное число координационных связей (дентатность). Если лиганд образует одну связь с центральным атомом, то это монодентатный лиганд.К монодентатным лигандам относятся Сl -, J -, Br -, CN -, ОН - и др. В случае монодентатных лигандов координационное число равно числу лигандов.
Бидентатный лиганд содержит два атома, которые образуют связь с центральным атомом. Например, этилендиамин (en) H2N - СН2 - СН2 - NH2 является бидентатным лигандом, в молекуле которого каждый из двух атомов азота образует одну связь с центральным атомом. В комплексном ионе [Cu(en)3]2+ координационное число меди равно 6, то есть в случае би - и полидентатных лигандов координационное число равно числу лигандов умноженному на дентатность К полидентатным лигандам относятся аминокислоты, белки пептиды, порфирины, которые называются еще биолигандами.
Заряд комплексного иона равен алгебраической сумме зарядов иона-комплексообразователя и лигандов:
 Aq+ + 2 CN - [Aq(CN)2] - ; (+1 - 2= -1)
Aq+ + 2 CN - [Aq(CN)2] - ; (+1 - 2= -1)
 Pt4+ + 6C1 [PtCL6]2 -. (+4- 6= -2)
Pt4+ + 6C1 [PtCL6]2 -. (+4- 6= -2)
Входящие в состав комплексного иона электронейтральные молекулы не влияют на величину его заряда. Если лигандами являются только электронейтральные молекулы, то заряд комплексного иона равен заряду комплексообразователя. Например, в комплексных ионах [Aq(NH3)2]+ и [Cu(NH3)4]2+ заряд ионов равен заряду комплексообразователя.
Ионы, не вошедшие во внутреннюю координационную сферу. Образуют внешнюю координационную сферу. Ионами внешней сферы часто являются ионы щелочных и щелочноземельных металлов, ионы аммония и анионы.
2. Природа химической связи в комплексных ионах
Для объяснения образования, строения и свойств комплексных соединений применяются
Различные теории, но наиболее наглядным и доступным является метод валентных связей (МВС)
Согласно МВС, в процессе образования комплексного иона устанавливается прочная связь между комплекснообразователем и лигандами. Механизм образования комплексного иона [Zn(NH3)4]2+.
Атом азота в молекуле аммиака имеет неподеленную пару электронов, а
ион Zn2+ имеет четыре свободные орбитали. Поэтому при образовании
комплексного иона [Zn(NH3)4]2+ роль донора играют четыре молекулы аммиака,
а роль акцептора - ион цинка Zn2+, который принимает четыре пары электронов
от четырех молекул аммиака. В образовании связи участвуют одна 4s- орбиталь
и три 4р-орбитали иона цинка. Комплексный ион [Zn(NH3)4]2+ имеет
геометрическую конфигурацию (тетраэдр), что означает осуществление sp -
гибридизации. Образование комплексного иона [Zn(NH3)4]2+ может быть
показано и следующим образом:

 NH3
NH3
â 2+
Zn2+ + 4NH3 à H3N à Zn ß NH3
á
NH3
Таким образом, с помощью МВС можно объяснить определенные
значения координационных чисел комплексных ионов. С позиций этого метода
хорошо объясняются и магнитные свойства комплексных соединений, но с его
помощью нельзя объяснить их оптические свойства: цвет и спектры
поглощаются. Для объяснения других физических и химических свойств
комплексных соединений применяется теория кристаллического поля и метод
молекулярных орбиталей.
3. Классификация и номенклатура комплексных соединений
Комплексные соединения классифицируются по заряду комплексного иона и по природе лигандов.
По заряду комплексного иона комплексные соединения делятся на катионные, анионные и нейтральные.
Катионные комплексные соединения.Если внутренняя сфера имеет положительный заряд, то такое комплексное соединение называется катионным.К ним относятся такие комплексные соединения, как [Cu(NH3)4]SO4; [Aq(NH3)2]Cl и др.
При названии этих соединений сначала называют анион, образующий внешнюю сферу комплексного соединения (например, SO4 2- -сульфат, NO3 - - нитрат, РO4 - - фосфат, С1- хлорид и т.д.). Если во внутреннюю сферу входят различные лиганды, то сначала идут названия электроотрицательных лигандов с окончанием "о" - (Сl - хлоро, CN - - циано и т.д.), а затем называются лиганды нейтральных молекул. Нейтральные лиганды именуются как свободные молекулы за следующими исключениями: Н2O - аква, NH3 - амин, СО - карбонил, NO- нитрозил, CS - тиокарбонил. Комплексообразователь называют по-русски в родительном падеже. Число лигандов указывают греческими числительными: 1 - моно, 2 -ди, 3 - три, 4 -тетра, 5 - пента, 6 гекса, 7 - гепта, 8 - окта. Приставка "моно" часто опускается. Степень окисления комплексообразователя указывается в скобках римской цифрой. Название комплексного катиона записывают одним словом.
[Aq(NH3)2]Cl - хлорид диамин серебра (I);
[Cu(NH3)4]SO4 - сульфат тетраамин меди (П);
[Co(NH3)4(NO2)Cl]NO3 - нитрат хлоронитротетрааминкобальта (Ш):] [Сг(Н2O)6]С1з - хлорид гексааквахрома (Ш).
Анионные комплексные соединения.У анионных комплексных соединений внутренняя сфера имеет отрицательный заряд. Их называют по тем же правилам, что и катионные комплексные соединения, но с добавлением суффикса «ат» к названию комплексообразователя. Сначала идет название комплексного аниона, а затем называют катион во внешней сфере:
K4[Fe(CN)6] гексацианоферрат (П) калия;
K[Pt(NH3)Cl3] - трихлороаминплатинат (II) калия;
Na3[Co(NO2)6 ] - гексанитрокобальтат (Ш) натрия;
Na[Co(NH3)2(NO2)4] - тетрачитродиаминкобальтат (Ш) натрия.
Нейтральные комплексные соединения.Некоторые комплексные
соединения-не имеют внешней сферы. У этих соединений отрицательный заряд
ионов внутренней сферы равен положительному заряду
комплексообразователя. Поэтому в целом молекула комплексного соединения электронейтральна и проявляет свойства неэлектролита. Такие комплексные соединения называют нейтральными.
Названия, нейтральных комплексных соединений составляются из названия лигандов, а комплексообразователь называют по-русски в именительном падеже. Степень окисления комплексообразователя не указывается. Название нейтрального комплексного соединения записывается, одним словом.
[Co(NH3)3Cl3] - трихлоротриаминкобальт;
[Fe(CO)5] - пентакарбонилжелезо;
[PtCl4(NH3)2] - тетрахлородиамйнплатина.
В основу другой классификации комплексных соединений положена природа лигандов.
Амминокомплексы (аммиакаты). В качестве лигандов выступают молекулы аммиака: [Cu(NH3)4]S04; [Co(NH3)6]Cl3; [Pt(NH3)6]Cl4.
Аквакомплексы.В качестве лигандов выступают молекулы воды: [Со(Н2O)6]С12; [Сr(Н2P)6]С13.
Ацидокомплексы.В качестве лигандов выступают кислотные остатки:
Сl- , CN - , N03 - и др. Примерами ацидокомплексов являются: K2[Cu(CN)4]; K3[Co(NO2)6].
ГидроксокомплексыВ качестве лигандов выступают гидроксид-ионы ОН -: Na3[Al(OH)6]; Na2[Zn(OH)4].
Карбонильные комплексы.В качестве лигандов выступает карбонил СО: [Ni(Co)4]; [Fe(Co)5]. В карбонильных комплексах Со-лиганды ковалентно связаны через атом углерода с металлом в нулевой степени окисления.
При изменении концентрации лиганда могут образовываться смешанные комплексные соединения, когда во внутренней координационной сфере находятся разные лиганды. Например, при взаимодействии избытка аммиака с хлоридом кобальта (Ш) происходит образование комплексного соединения, которое содержит во внутренней сфере 6 молекул аммиака:
СоС13 + 6NH3 = [Co(NH3)6]Cl3 При добавлении меньших количеств аммиака образуются комплексные соединения с разным числом молекул аммиака и хлорид ионов во внутренней сфере:
СоС13 + 5NH3 = [Co(NH3)5Cl]Cl2;
СоС13 +4NH3 = [Co(NH3)4Cl2]Cl;
CoCl3 + 3NH3 = [Co(NH3)3Cl3].
4. Диссоциация комплексных соединений
Внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости. Ионы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе. Лиганды во внутренней сфере связаны с комплексообразователем значительно прочнее и отщепляются лишь в незначительной степени. В связи с этим диссоциация комплексных соединений протекает в две стадии.
На первой стадии диссоциация идет по типу сильных электролитов, на второй стадии - по типу слабых электролитов ступенчато, обратимо и частично.
Первая стадия [Ag(NH3)2] С1 а=1 [Ag(NH3)2]+ + Сl -
Вторая стадия [Ag(NH3)2] a< 1 Ag+ + 2NH3
Вторая стадия характеризуется равновесием между комплексным ионом, комплексообразователем и лигандами. Диссоциация ионов [Ag(NH3)2]+ выражается константой химического равновесия:
Кх.р = [Ag+][NH3]2
[Ag(NH3)2]+
Константа равновесия Кх.р. в случае диссоциации комплексного иона называется константой нестойкости (Кн). Она характеризует устойчивость внутренней сферы комплексного соединения.
Смещение диссоциации вправо комплексного соединения [Ag(NH3)2]Cl по типу слабых электролитов ведет к разрушению комплексного иона и образованию нового, характеризующегося меньшей константой нестойкости, поэтому при добавлении цианид-ионов CN - к раствору комплексного иона [Ag(NH3)2]+ последний разрушается с образованием более устойчивого комплексного иона [Ag(CN)2] -:
[Ag(NH3)2 ] CI + 2RCN = R[Ag(CN)2] + RC1 + 2NH3;
[Ag(NH3)] + + 2CN- = [Ag(CN)2] - +2NH3
Для разрушения комплексного иона надо связать один из ионов,
образующихся по второй стадии, в виде комплексного соединения, осадка или
провести окисление либо восстановление:
[Ag(NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3;
2K2[Ni(CN)4] + Br2 + 6KOH = 2Ni(OH)3 + 2KBr + 8KCN.
Для характеристики устойчивости комплексных соединений пользуются также величиной, обратной константе нестойкости. Эту величину называют константой устойчивости (Ку). Для комплексного иона [Ag(NH3)2]+.
5. Применение комплексных соединений в медицине и химическом анализе
В состав комплексных соединений в качестве лигандов входят и биологически важные соединения: аминокислоты, белки, Зполипептиды, нуклеиновые кислоты, порфирины, АТФ. Изучение процессов, протекающих в организме с образованием комплексных соединений, может иметь большое значение для профилактики и лечения ряда заболеваний.
Белки являются полидентатными лигандами и хорошо связываются с тяжелыми металлами. При отравлении солями тяжелых металлов пострадавшему дают пить молоко и сырые яйца, которые содержат много белков. Образующиеся комплексные соединения. Не всасываются в кровь из кишечника и тяжелые металлы, таким образом, выводятся из организма.
Наибольшее распространение в живой природе получили порфирины, которые входят в состав гемоглобина, хлорофилла и некоторых ферментов (каталаза, пероксидаза). Порфирины имеют донорные атомы азота и образуют прочные координационные соединения с катионами различных металлов. В качестве центрального атома может выступать ион Mg2+. В результате образуется активный центр хлорофилла - зеленого пигмента растений. Если присутствуют ионы Fe2+ или Сu + , образуются активные центры гемоглобина и гемоцианина. Ион кобальта Со3+ является центральным атомом в витамине B12, который представляет собой бионеорганическое комплексное соединение порфиринового ряда.
Главным источником энергии для многих биологических процессов является АТФ, которая находится в организме в виде комплексных солей кальция и магния.
В медицинской практике и в аналитической химии широко используются комплексоны. Среди них наиболее важное значение имеет ЭДТА. С помощью этой соли ускоряется выведение из организма токсичных металлов: свинца, ртути, кадмия, бария и др. Образующиеся комплексные соединения водорастворимы и, практически не расщепляются в биологической среди, что является их фармакологической особенностью. Способность к образованию прочных комплексных соединений со многими металлами проявляется и у других солей ЭДТА - кальциевых, кобальтовых. Например, кальциевая соль СаNa2ЭДТА (тетацион) широко используется при отравлении свинцом.
Некоторые комплексы платины замедляют рост злокачественных заболеваний, а комплексы золота с a-тиоспиртами оказывают лечебное действие при туберкулезе и проказе.
Жизненно необходимые элементы Zn, Cu, Fe, Mn, Мо входят в состав определенных ферментов, которые называются металлоферментами. Они выполняют специфические функции в организме.
Реакции комплексообразования лежат в основе многих методов химического анализа. Их широко используют для обнаружения, определения, маскировки ионов, растворения, разделения и концентрации веществ.
Обнаружение отдельных ионов в качественном анализе осуществляется с помощью комплексных соединений. Процесс обнаружения сопровождается разрушением исходных и образованием новых комплексных соединений, что ведет к появлению или изменению цвета осадков или растворов. Например, это наблюдается при проведении реакций обнаружения ионов К+, Fe2+, Cu2+ и др.:
Na3[Co(NO2) 6 ] + 2KC1 = K2Na[Co(NO2)6] â + 2NaCl;
Желтый
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 â + 3K2SO4;
Темно-синий
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CNO6]3 â + 12KC1;
Синий
CuSO4 + 4NH3= [Cu(NH3)4]SO4
Избыток Ярко-синий
Комплексные соединения используются также для устранения мешающего влияния некоторых ионов («маскировка» ионов). Например, ион железа Fe +, мешающий определению ряда катионов, маскируют, связывая его в комплекс с фторид-ионами [FeF6]-3 или винной, или лимонной кислотами.
При обнаружении ионов Zn2+ в присутствии ионов Fe3+ с помощью реактива (NH4)2[Hg(SCN)4] катионы Fe3+ образуют соединение Fe(SCN)3, имеющее кроваво-красную окраску. Поэтому в присутствии ионов Fe3+ белый осадок комплексного соединения цинка не виден.
Комплексные соединения применяются для изменения кислотно-основных и окислительно-восстановительных свойств катионов и анионов. При связывании слабых кислот в комплекс их сила увеличивается вследствие ослабления связи аниона с ионами водорода. Например, кислотные свойства щавелевой кислоты увеличиваются в присутствии ионов магния Mg2+, так как образующийся комплекс H2[Mg(C2O4)2] обладает большей силой как кислота. Аналогично возрастает сила борной кислоты при ее связывании в комплекс с глицерином или маннитом, имеющими несколько гидроксильных групп. При анализе катионов и анионов комплексообразование может усиливать или ослаблять окислительно-восстановительные свойства соединений. Например, окислительные свойства ионов Fe3+ резко понижаются в случае образования оксалат-ионами С2O42- фосфат-ионами РO43- и фторид-ионами F- прочных комплексных ионов:
[Fe(C2O4)3]3-, [Fe(PO4)2]3 - , [FeF3]3-
Комплексообразование широко используется в анализе для перевода малорастворимых соединений в раствор и разделения ионов. Например, осадок Hgl2 растворяется в избытке К1 с образованием водорастворимого комплекса
K2[HgI4]; осадок AgCl растворяется в растворе аммиака с образованием комплекса [Ag(NH3)2]Cl.
Способность осадка AgCl растворяться в растворе аммиака в отличие от осадка Hg2Cl2, позволяет отделить ионы Ag+ от ионов Hg2 .
Реакции комплексообразования легли в основу многих количественных определений металлов.
Вопросы для самоподготовки:
1. Чем отличаются комплексные соединения от двойных солей?
2. Что такое ион-комплексообразователь? Какие ионы могут выполнять роль комплексообразователя?
3. Что такое лиганды? Приведите примеры.
4. Что такое координационное число? Какие ионы имеют координационные числа 2, 4, 6? Приведите примеры.
5. Определите степень окисления иона-комплексообразователя в следующих комплексных ионах:[PtCl]2-; [Cu(CN)4]2-; [Ni(NH3)Cl]5; [Co(NH3)2)NO2)4]-; [Cr(H2O)4Br2]+; [Hg(CN)4]; [Ag(S2O3)2]3-
6. Укажите комплексообразователь, лиганды и координационное число в комплексных соединениях: K2[Hgl4]; H3[A1F6]; H[BF4]; [PtCl(NH3)5]Cl; [Co(H2O)6](NO3)3.
7. Укажите величину и знак заряда комплексных ионов: [Сг(Н2O)4С12]С1; Ni(NH3)5Cl; [Co(NH3)5Br]; K[Ag(CN)2], Zn[Fe(CN)6].
8. Укажите внешнюю и внутреннюю координационную сферы комплексных соединений: K4[Fe(CN)6]; [Pt((NH3)5Cl]Cl3; K[Sb(OH)6]; [Co(NH3)6]SO4; Na3[Co(NO2)6].Напишите уравнения диссоциации этих комплексных соединений.
9. Назовите комплексные соединения: K4[Fe(CN)6]; K3[Fe(CN)6]; [Cr(NH3)6](NO3)3; [Ag(NH3)2]Cl; K[Co(NH3)2(NO2)4].
10.Напишите химические формулы следующих комплексных соединений: а) дицианоаргентат калия; б) гексацианоферрат (П) цинка; в) хлорид дихлоротетрааква хрома (Ш); г) гексахлороплатинат (IV) калия; д) бромид гексаамминкобальта (Ш).
11. Составьте формулы комплексных соединений:
а) комплексообразователь Со3+, координационное число 6, лиганды -молекулы воды, во внешней координационной сфере находятся нитрат-ионы; б) комплексообразователь Pt2+, координационное число 4, лиганды – Сl - -ионы, во внешней сфере находятся ионы калия; в) комплексообразователь О +, координационное число 6, лиганды - три молекулы аммиака и три Сl - - иона, внешней координационной сферы нет.
Лекция № 10
Тема: Растворы, способы выражения состава растворов.
План
1. Растворы. Механизм образования растворов и их классификация.
2. Растворимость. Факторы, влияющие на растворимость.
3. Дисперсные системы и их классификация.
4. Коллоидные растворы и их свойства.
5. Классификация способов выражения количественного состава растворов. 6.Массовая процентная концентрация
7.Молярная концентрация.
8.Молярная концентрация эквивалента
1. Растворы. Механизм образования растворов и их классификация.
Растворы - это гомогенные системы переменного состава, находящиеся в состоянии химического равновесия. Растворы представляют собой дисперсные системы, в которых частицы одного вещества равномерно распределены в другом. Дисперсные системы по характеру агрегатного состояния могут быть газообразными, жидкими и твердыми, а по степени дисперсности - взвесями, коллоидными и истинными растворами. Частицы взвесей обычно имеют размер порядка 1 мкм и более. Такие частицы сохраняют все свойства фазы. Поэтому взвеси следует рассматривать как гетерогенные системы.
При образовании истинного раствора распределенное в среде вещество диспергировано до атомного или молекулярного уровня. Примеры таких систем многочисленны: воздух (газообразный раствор, содержащий кислород, азот и т.д.); жидкие водно-солевые системы; сплавы меди с золотом представляют собой пример твердых растворов.
Для истинных растворов - термодинамически равновесных систем - характерна неограниченная стабильность во времени. Наибольшее значение имеют жидкие, а в последнее время и твердые растворы, находящие широкое применение в самых различных областях науки и техники.
Растворы - это как минимум двухкомпонентные системы. Обычно растворителем считают компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор.
Растворение обычно сопровождается заметным тепловым эффектом (эн-до- или экзотермическим), изменением объема (общий объем раствора не равен сумме объемов компонентов), иногда изменением окраски и т.п. Например, при растворении гидроксида калия в воде наблюдается сильное разогревание раствора:
КОН+ aq = КОН . aq ( D Н = -54 кДж),
а при растворении нитрата аммония - охлаждение:
NH4N03+aq=NH4N03 . aq (D Н= + 25 кДж)
При смешении 100 мл воды с равным объемом этилового спирта вместо ожидаемых 200 мл раствора получается около 180 мл, то есть в результате растворения происходит уменьшение объема. Растворение безводного сульфата меди, не имеющего окраски, сопровождается появлением интенсивной голубой окраски.
Дата добавления: 2016-11-22; просмотров: 2161;
