Химические свойства
Строение карбоксильной группы:
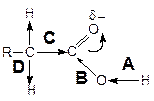
Смещение электронной плотности под действием полярной двойной С=О связи приводит к тому, что реакционными центрами в молекулах карбоновых кислот являются:
A.Связь О–Н карбоксильной группы.
B. Связь С–ОН карбоксильной группы.
C.Связь R–СООН.
D. Связь С–Н атома водорода в a-положении к карбоксильной группе.
A. Диссоциация карбоксильной группы с отщеплением катиона водорода:
RCOOH  RCOO– + H+
RCOO– + H+
(карбоновые кислоты проявляют свойства слабых кислот)
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индуктивного эффекта. Такие заместители, как хлор или фенильный радикал оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индуктивный эффект (-/). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие заместители, как алкильные группы, обладают электронодонорными свойствами и создают положительный индуктивный эффект, +I. Они понижают кислотность.
В образующемся при диссоциации карбоксилат-анионе связи С–О выровнены, отрицательный заряд равномерно распределен между двумя атомами кислорода:

Поэтому двойная С=О связь в карбоновых кислотах неактивна.
Кислотные свойства карбоновых кислот:
2СH3COOH + Fe ® (СH3COO)2Fe + H2;
2CH3COOН + MgO ® (CH3COO)2Mg + H2O;
CH3COOH + KOH ® CH3COOK + H2O;
CH3COOH + NaHCO3 ® CH3COONa + CO2 + H2O.
B. Реакции с отщеплением гидроксильного ОН-радикала (нуклеофильное замещение в карбоновых кислотах, реакции ацилирования)
Реакции этерификации (взаимодействие со спиртами, приводящее к образованию сложных эфиров):
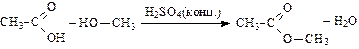
метиловый эфир уксусной кислоты (метилацетат)
Образование галогенангидридов:
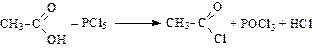
ацетилхлорид
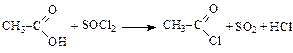
Реакции с аммиаком при нагревании (образование амидов):
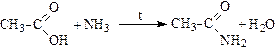
Получение ангидридов кислот при нагревании:
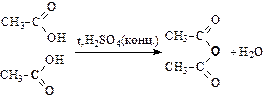 (уксусный ангидрид)
(уксусный ангидрид)
С. Декарбоксилирование (отщепление карбоксильной группы)
CH3COONa + NaOH 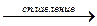 CH4 + Na2CO3
CH4 + Na2CO3
(СН3СОО)2Са 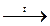 СН3СОСН3 + СаО + СО2
СН3СОСН3 + СаО + СО2
D. Реакции с участием углеводородного радикала
CH3–CH2–COOH + Сl2 ® CH3–CHCl–COOH + HCl
Дата добавления: 2016-11-02; просмотров: 965;
