ВСЕ ВЫШЕСКАЗАННОЕ И ЯВЛЯЕТСЯ ПРИЧИНОЙ РАЗВИТИЯ ПОН ПРИ СЕПСИСЕ
ПАТОГЕНЕЗ СЕПСИСА
На сегодня, имеются все основания утверждать, что в основе сепсиса лежит формирование реакции генерализованного воспаления, инициированной инфекционным агентом, с неконтролируемым выбросом эндогенных медиаторов воспаления и недостаточность механизмов ограничивающих их эффект, что является причиной органно-системных повреждений.
Воспаление — типический патологический процесс, который развивается при повреждении тканей и проявляется нарушением кровообращения, изменением крови и соединительной ткани в виде альтерации, экссудации и пролиферации.
В этот, преимущественно местный, процесс в той или иной мере вовлекается весь организм и прежде всего сердечно-сосудистая, иммунная, эндокринная и нервная системы.
Патогенетические механизмы воспаления являются генетически детерминированными. Процесс носит выраженный стадийный характер.
1 стадия – стадия эндотоксемии,
2 стадия – синдром системного воспалительного ответа,
3 стадия – стадия повреждения эндотелия сосудов,
4 стадия – стадия клинических проявлений
Воспаление по своей сущности процесс противоречивый. В нем сочетаются и мобилизация защитных сил организма, и явления повреждения. Организм защищается от воздействия чуждых и вредных ему факторов путем отграничения воспалительного очага от всего организма. Это предотвращает распространение и генерализацию воспалительного процесса, сосредоточивая борьбу с вредным агентом в одном очаге. Воспаленная зона не только локализует всё, что происходит в ней, но и поглощает токсические вещества, циркулирующие в крови.
Это объясняется формированием вокруг очага воспаления своеобразного барьера с односторонней проницаемостью. Такой барьер создается путем закупорки отводящих лимфатических и кровеносных сосудов и блокады внесосудистого тканевого транспорта. Окончательно барьер формируется вследствие размножения соединительно-тканных клеток на границе между здоровой и пораженной тканью.
В очаге воспаления создаются неблагоприятные условия для жизни микроорганизмов. Их уничтожают фагоциты и специфические антитела, а также ферменты и основные белки.
С другой стороны, воспаление всегда несет в себе элемент разрушения. Борьба с "агрессором" в зоне воспаления неизбежно сочетается с гибелью собственных клеток. В некоторых случаях начинает преобладать альтерация, что приводит к гибели ткани или целого органа. Экссудация может вызвать нарушение питания ткани, ее ферментативное расплавление, гипоксию и общую интоксикацию.
Таким образом, воспаление - это патологический процесс, в котором амбивалентность в виде "защиты" и "разрушения", что подтверждает философский закон "единства и борьбы противоположностей".
Отсюда и два возможных исхода: выживание или смерть.
Этап 1. Этиологическим моментом сепсиса является проникновение в организм патогенных микроорганизмов.
Инфекционные агенты, попавшие в организм, выделяют большое число разнообразных патогенных факторов:
- экзотоксины (липопротеины, пептидогликан, тейхоевая кислота),
- эндотоксины (LPS — липополисахарид, компонент ресничек бактерий флагеллин, ДНК, РНК и др.)
Этап 2. В ответ на появление повреждающих факторов активизируется иммунная система.
Иммунитет имеет клеточный и гуморальный компоненты:
- Клеточный компонент реакции иммунной системы на инфекционный агент обусловлен активацией нейтрофилов, макрофагов, моноцитов и лимфоцитов.
- Гуморальный компонент характеризуется активацией систем комплемента, коагуляции и фибринолиза, а также кининовой системы.
Клеточный компонент реакции иммунной системы на инфекционный агент обусловлен активацией клеток (нейтрофилов, макрофагов, моноцитов и лимфоцитов) и проявляется:
- адгезией,
- хемотаксисом,
- хемокинезом,
- высвобождающихся из различных клеток провоспалительных и противовоспалительных медиаторов, которые, наряду с процессом нейтрализации чужеродного агента, могут повреждать собственные ткани и вести к развитию ПОН – элемент гуморального компонента.
Все это характеризует начало этапа воспалительных изменений в организме.
Пример - Активация макрофагов, представленная на слайде
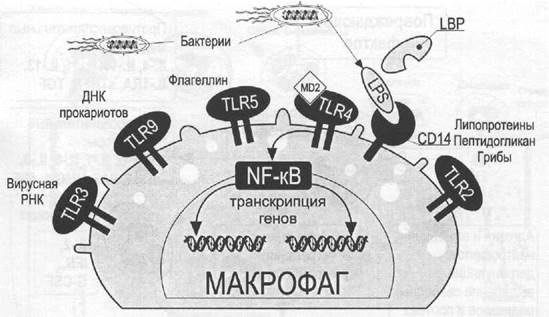
Сепсис и острое повреждение легких: модуляция транскрипции генов (Opal S.M. et at., 2003, с модификациями)
TLR — Toll-like receptors (Толл-подобные рецепторы); LP5 — lipopolysactharide (липополисахарид); LBP — Ilipopolysaccharide binding protein (липополисахарид-связывающий протеин); NF-кВ — nuclear factor-кВ (ядерный фактор каппа-В).
Экзотоксины (липопротеины, пептидогликан, тейхоевая кислота), эндотоксины (LPS - липополисахарид), компонент ресничек бактерий флагеллин, ДНК, РНК и др. активируют семейство Толл-подобных рецепторов (TLR — Toll-like receptors).
На уровне ядра клетки это взаимодействие проявляется изменением транскрипции генов, отвечающих за синтез и выделение клеточных и гуморальных компонентов ССВО. Аналогичные процессы происходят и в других клетках.
Нейтрофилы:
Резюмируя вышесказанное кратко схему запуска воспалительной реакции можно представить следующим образом:
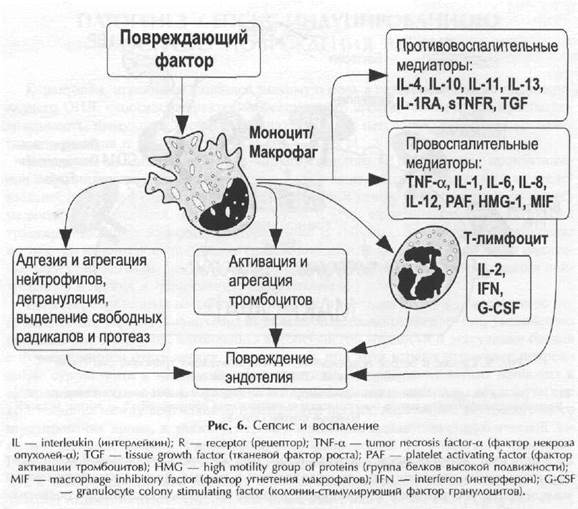
Высвобождение из клеток крови провоспалительных и противовоспалительных медиаторов (цитокинов) один из важнейших этапов процесса воспаления.
Цитокины - это растворимые пептиды, выполняющие функции медиаторов иммунной системы и обеспечивающие клеточные кооперации, позитивную и негативную иммунорегуляцию [3,6]. Эти биорегуляторные молекулы определяют тип и длительность воспалительного и иммунного ответа, контролируют пролиферацию клеток, гемопоэз, ангиогенез, заживление ран и многие другие процессы [24,54]. Все исследователи подчеркивают, что цитокины лишены специфичности в отношении антигенов [3,6,7,40].
Считается, что пусковым механизмом развития патологического воспаления является несбалансированная цитокинемия [7, 24].
В настоящее время известно более ста цитокинов, которые традиционно разделяют на несколько групп [3,6,7,24].
1. Интерлейкины (IL-1 - IL18) - секреторные регуляторные белки, обеспечивающие медиаторные взаимодействия в иммунной системе и ее связь с другими системами организма.
2. Интерфероны (IFN-альфа, бета, гамма) - противовирусные цитокины с выраженным иммунорегуляторным действием.
3. Факторы некроза опухоли (TNF альфа, бета) - цитокины с цитотоксическим и регуляторным действием.
4. Колониестимулирующие факторы (G-CSF, M-CSF, GM-CSF) - стимуляторы роста и дифференцировки гемопоэтических клеток, регулирующие гемопоэз.
5. Хемокины (IL-8, IL-16) - хемоаттрактанты для лейкоцитов.
6. Факторы роста - регуляторы роста, дифференцировки и функциональной активности клеток различной тканевой принадлежности (фактор роста фибробластов, фактор роста эндотелиальных клеток, фактор роста эпидермиса) и трансформирующие факторы роста (TGF бета).
Известно, что в зависимости от природы, цитокины действуют:
аутокринно - на сами клетки продуценты,
паракринно - на другие клетки – мишени,
эндокринно - на разные клетки за пределами места их продукции.
При этом они могут взаимодействовать друг с другом по агонистическому или антагонистическому принципу, изменяя функциональное состояние клеток-мишеней и формируя цитокиновую сеть.
Таким образом, цитокины представляют собой не разрозненные пептиды, а целостную систему, основными компонентами которой являются клетки-продуценты, сам белок - цитокин, рецептор его воспринимающий, и клетка-мишень.
Например, определена способность IFN гамма и TNF альфа индуцировать экспрессию молекул адгезии - ICAM -1 на эндотелиоцитах человека. Молекулы адгезии, прилипая к лейкоцитам, тромбоцитам и клеткам эндотелия, формируют "rolling" (крутящиеся) нейтрофилы и способствуют агрегации частиц фибрина.
Дальнейшая миграция лейкоцитов в очаг воспаления контролируется специальными цитокинами - хемокинами, которые продуцируются и секретируются не только активированными макрофагами, но и эндотелиальными клетками, фибробластами, гладкими миоцитами. Их основная функция - поставлять нейтрофилы в очаг воспаления и активировать их функциональную активность. Основным хемокином для нейтрофилов является Il-8. Наиболее сильными его индукторами служат бактериальные липополисахариды, IL-1 и TNFальфа.
Предполагается, что каждый шаг трансэндотелиальной миграции нейтрофилов регулируется стимулирующими концентрациями TNF альфа.
Клеточный иммунитет реализуется через «клетки воспаления».
| Клетки | БАВ | действие |
| Макрофаги: фиксированные, подвижные, печеночные, легочные, селезеночные. | Интерлейкин-L, ферменты, интерферон, фрагменты комплемента, простагландины, ингибиторы протеаз. | Фагоцитоз. Кооперация с другими клетками воспаления. Действие на фибробласты, лимфоциты, гепатоциты, нейроны. |
| Тучные клетки | Гистамин, фактор хемотаксиса эозинофилов, гепарин, фактор активации тромбоцитов, медленно реагирующая субстанция. | Выработка биологически активных веществ |
| Нейтрофилы | Фактор активации тромбоцитов, лейкотриены, ферменты, антимикробные факторы. | Хемотаксис, фагоцитоз, цитотоксическое действие. |
| Эозинофилы | Гистаминаза, арилсульфатаза, большой катионный белок. | Деградация гистамина, лейкотриенов. |
| Тромбоциты (кровяные пластинки) | Простагландины, тромбоксан, лейкотриены; тромбоцитарный фактор роста, фактор проницаемости, катионные белки, серотонин, гистамин, гидролазы, адреналин. | Агрегация, свертывание крови. |
| Лимфоциты Т и В | Интерлейкины, лимфокины, Иммуноглобулины. | Иммунитет, киллерное действие. |
| Фибробласты | Коллаген, гликоэамингликаны, фибронектин. | Миграция, пролиферация, созревание; восстановление дефекта. |
Клеточный и гуморальный компоненты иммунного ответа тесно взаимосвязаны:
1. Выделение макрофагами цитокинов (фактор некроза опухолей-а (TNF-а), интерлейкины (IL-1 и IL-6), интерфероны (IFN)) приводит к повреждению эндотелия, что еще более усиливает синтез медиаторов воспаления (Jacobs R. et al., 1989).
2. Благодаря механизму обратной связи TNF-a активирует нейтрофилы и потенцирует синтез других цитокинов (Pearl R.G., 1995).
3. Интерлейкин-1 не только потенцирует пирогенный эффект цитокинов, но и, вместе с TNF-a, стимулирует выход из активированных клеток токсичных свободных радикалов и протеолитических ферментов.
4. Фосфолипаза А2, в свою очередь, воздействует на клеточные мембраны нейтрофилов и эндотелиальных клеток, что ведет к высвобождению эйкозаноидов и фактора активации тромбоцитов (PAF).
5. Эйкозаноиды представляют собой производные арахидоновой кислоты и включают в себя продукты ее метаболизма, протекающего по циклооксигеназному (тромбоксан А2 (ТхА2) и простагландины) и липооксигеназному (лейкотриены) путям.
6. ТхА2 вызывает агрегацию тромбоцитов, индуцирует бронхоконстрикцию и, вместе с лейкотриенами, приводит к увеличению сосудистой проницаемости (Pearl R.G., 1995).
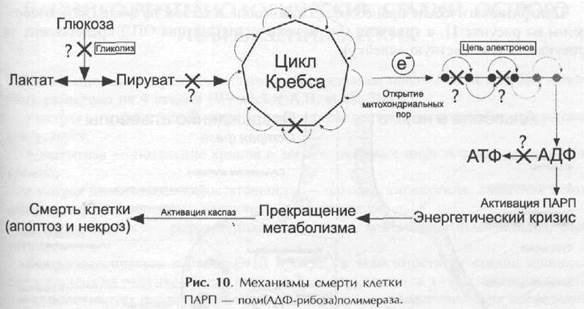
Воздействие цитокинов и бактериальных продуктов ведет к развитию тканевой гипоксии за счет перехода клеток тканей на анаэробный метаболизм. Переход клетки на анаэробный метаболизм запускает процесс программированной клеточной смерти, или апоптоз. Данный вариант распада клетки опосредуется активацией генов, ответственных за экспрессию внутриклеточных энзимов поли-полимеразы и каспаз (биохимических маркеров апоптоза), что сопровождается фрагментацией ДНК, нарушением функции митохондрий, энергетическим кризисом и гибелью клеток. В отличие от некроза, апоптоз сопровождается выработкой противовоспалительных медиаторов (Green D.R. et al., 2000).
Причина перехода на анаэробный метаболизм:
1. снижение утилизации глюкозы (отсюда гипергликемия).
2. прекращением синтеза пирувата из глюкозы – исходного субстрата цикла Кребса.
3. Активация синтеза лактата из глюкозы.
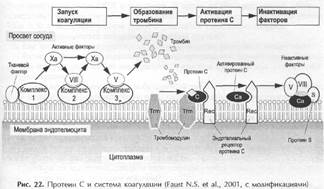
Существенное значение при септическом состоянии имеет активация коагуляционного каскада и запуск ДВС-синдрома. В данный процесс активно вовлечены легкие, одной из недыхательных функций которых является участие в регуляции гемостаза и синтез целого ряда антикоагуляционных и прокоагуляционных факторов.
В норме (на слайде) Протеин С, являясь естественным антикоагулянтом, уравновешивает спонтанную коагуляцию. Активация при сепсисе коагуляционного каскада истощает эндогенные запасы Протеина С и вызывает сдвиг баланса коагуляции/антикоагуляции в сторону гиперкоагуляции.
Протеин С - первичный антикоагулянт, обладает, кроме того, противовоспалительными и фибринолитическими свойствами (Kuklin V.N. et al., 2003).
Результат вышесказанного – неконтролируемое организмом увеличение проницаемости клеточных мембран эндотелия сосудов. Поражение эндотелия капилляров приводит:
1. к развитию интерстициального отека,
2. к нарушениям микроциркуляции и микротромбозам
3. к тканевой и органной гипоксии с нарушением функции. Гипоперфузия тканей выявляется гипотензией с наличием лактат-ацидоз, который является патогномоическим показателем тканевой гипоксии!!!
4. особое значение – поражение ЖКТ с транслокацией бактерий и потенциированием ПОН
ВСЕ ВЫШЕСКАЗАННОЕ И ЯВЛЯЕТСЯ ПРИЧИНОЙ РАЗВИТИЯ ПОН ПРИ СЕПСИСЕ
Какова же грань между «физиологическим» и «патологическим» воспалением? Вопрос сложный, нигде толком не освещенный, однако по логике вещей развитие даже элементов ПОН это уже - «патологическое» воспаление.
В классической патофизиологии все вышесказанное умещается в 3 стадии воспаления.
I. Стадия альтерации (повреждения):
А. Первичная альтерация
Б. Вторичная альтерация
II. Стадия экссудации и эмиграции
III. Стадия пролиферации и репарации:
А. Пролиферация
Б. Завершение воспаления
Дата добавления: 2016-11-02; просмотров: 789;
